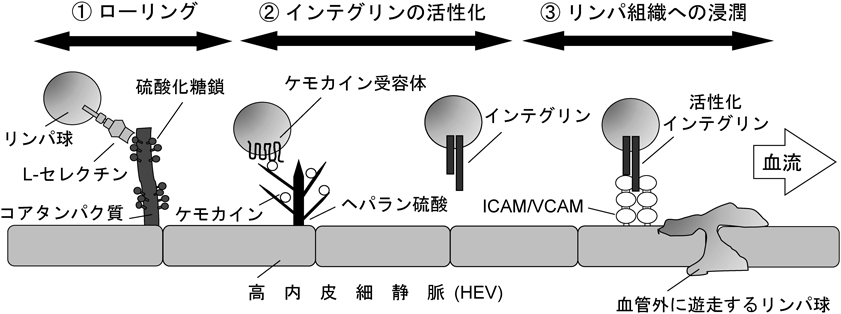
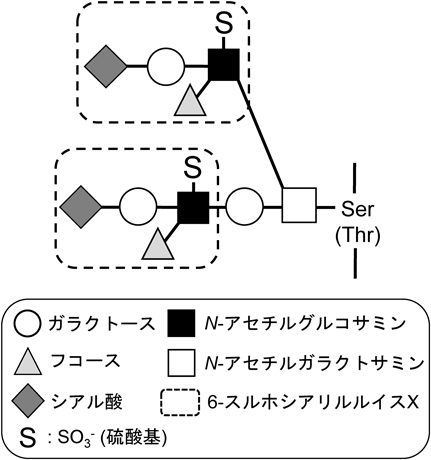
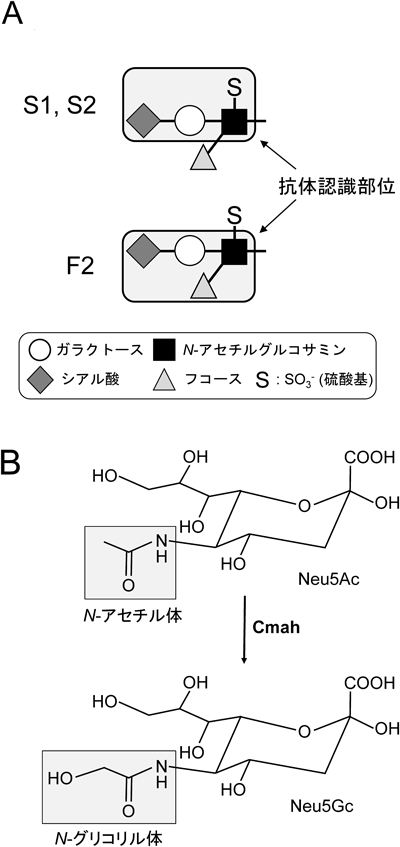
新規抗糖鎖モノクローナル抗体を用いたリンパ球体内動態の解析Functional analysis of sulfated glycans in lymphocyte homing using novel anti-carbohydrate monoclonal antibodies
千葉大学大学院薬学研究院免疫微生物学研究室Laboratory of Microbiology and Immunology, Graduate School of Pharmaceutical Sciences, Chiba University ◇ 〒260–8675 千葉県千葉市中央区亥鼻1–8–1 ◇ 1–8–1 Inohana, Chuo-ku, Chiba 260–8675, Japan