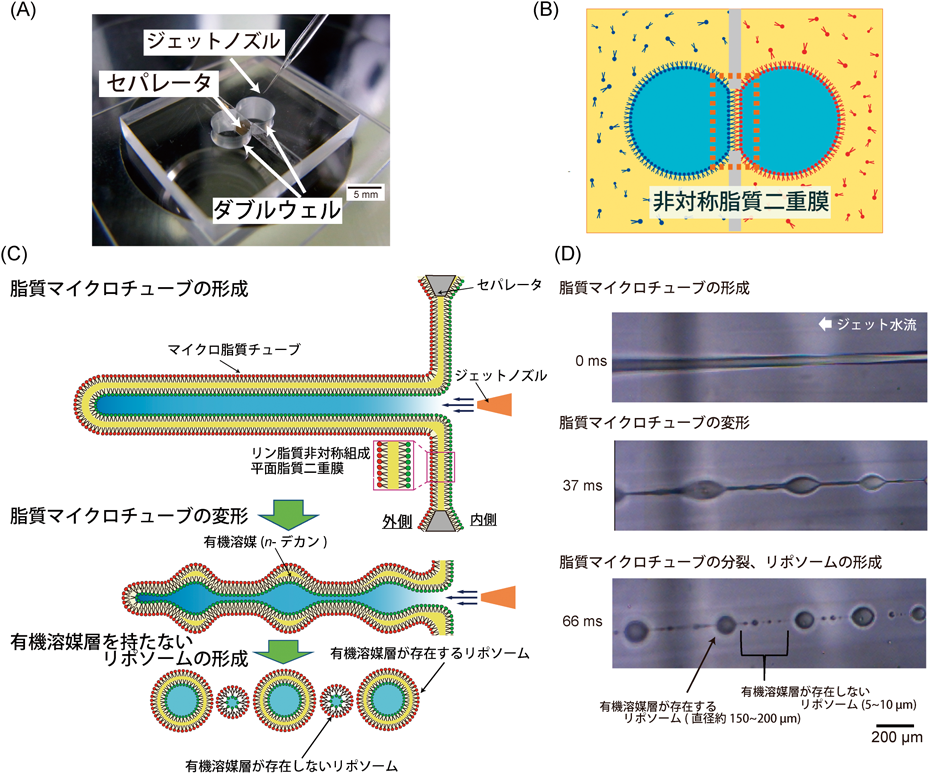
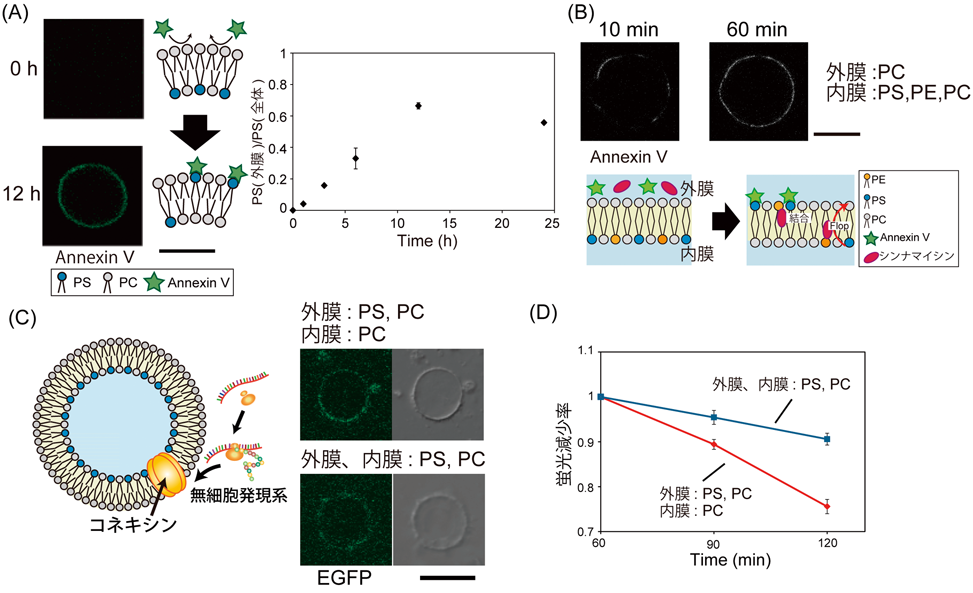
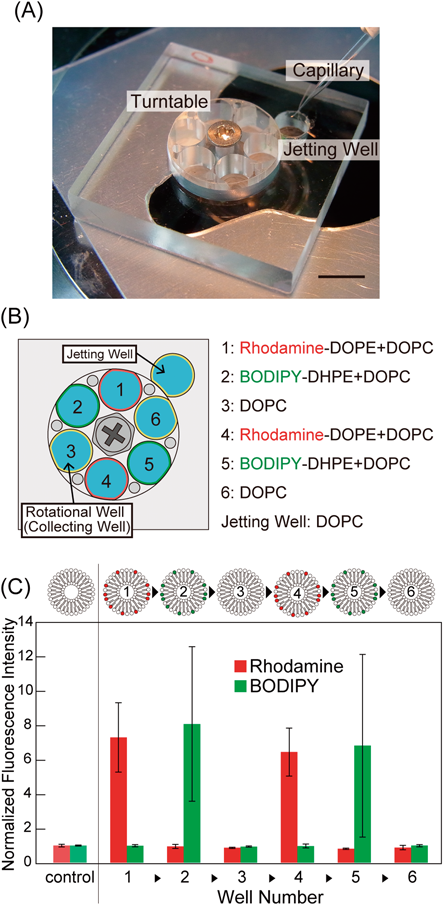
リン脂質非対称組成の人工細胞膜作製と生体分子相互作用観察Asymmetric lipid artificial membrane formation and biomolecule interaction investigation
1 神奈川県立産業技術総合研究所人工細胞膜システムグループArtificial Cell Membrane Systems Group, Kanagawa Institute of Industrial Science and Technology ◇ 神奈川県川崎市高津区坂戸3–2–1 KSP 東棟303 ◇ KSP EAST 303, 3–2–1 Sakado, Takatsu-ku, Kawasaki Kanagawa
2 東京大学生産技術研究所Institute of Industrial Science, The University of Tokyo ◇ 東京都目黒区駒場4–6–1 Fw205 ◇ 4–6–1 Komaba, Meguro-ku, Tokyo