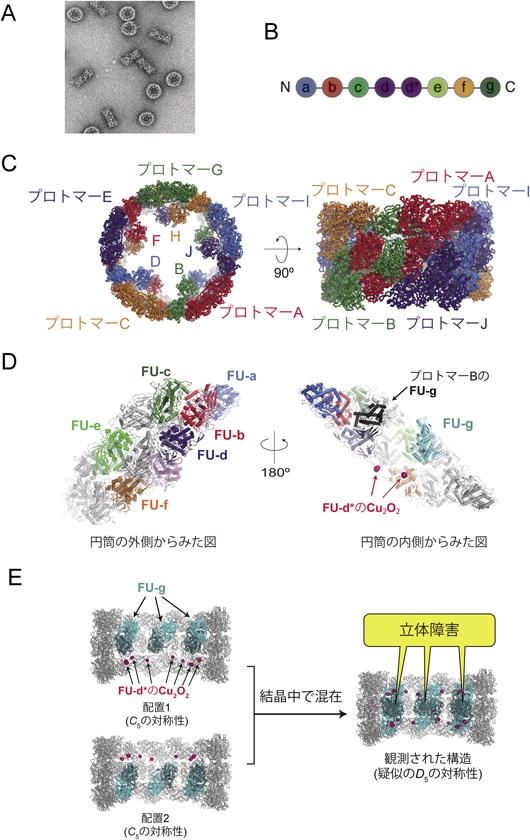
酸素運搬タンパク質は生命維持に不可欠な酸素を運ぶ役割を担っている.脊椎動物の酸素運搬タンパク質は赤血球のヘモグロビンであるが,ヘモグロビンに次いで多くの生物種でみられる酸素運搬タンパク質がヘモシアニンである.ヘモシアニンは多くの軟体動物および節足動物の血リンパ液に直接溶解する細胞外タンパク質で(図1A),活性中心に2分子のCu2+が配位するタイプ3銅含有タンパク質であり,その酸素結合型は青色を呈する.同じヘモシアニンでも軟体動物と節足動物のものでは分子構造がまったく異なっており,軟体動物ヘモシアニンのサブユニットは330~450 kDaと大きく,約50 kDaの相同性の高い(アミノ酸配列の相同性は約40%程度)機能ドメイン(Functional Unit,以下FUと記載する)の繰り返しからなる構造である(図1B).この大きなサブユニットの十量体がベースとなり,頭足類の分子は十量体1個が1分子,腹足類の分子は十量体2個(二十量体)もしくは3個以上で1分子を構成する1, 2).ここで特筆すべき点はその巨大な分子量で,小さいもので330万,大きいものでは1000万を超えるため,軟体動物ヘモシアニンはタンパク質の中でも最大分子の一つにあげられる.このような細胞外巨大酸素運搬タンパク質の生化学研究としては,有鬚動物門に属するマシコヒゲムシの巨大ヘモグロビン(分子量40万)の分子構造解析が知られており3),無脊椎動物の進化および環境適応に酸素運搬タンパク質の巨大化と分子構造がどう関わっているか興味深いところである.また,KLH(キーホールリンペットヘモシアニン)で知られるように,軟体動物ヘモシアニンは抗原性刺激に優れ,抗体作製時のキャリアタンパク質として使用されており,最近では免疫賦活剤や抗がん治療併用剤として応用されている4).ヘモシアニンの生理機能の詳細な解明やさらなる応用研究に向け,高分解能の構造解析が切望されてきたが,その分子のあまりの巨大さから結晶化は困難を極め,これまでは主としてクライオ電子顕微鏡による構造解析が行われてきた5–8).本研究では軟体動物ヘモシアニン会合体分子の初めてのX線結晶構造解析に取り組み,3.8 MDaのスルメイカ由来ヘモシアニンの会合体構造を3.0 Åの分解能で決定することに成功した9–11).本稿では,結晶構造解析によって明らかとなった原子レベルでの全体構造や,会合様式,糖鎖の役割について紹介する.
スルメイカヘモシアニンは385 kDaのサブユニットの十量体である.結晶化に際しては会合体構造を保つことに最も注力した.スルメイカから採取した血リンパはヘモシアニンを高濃度(100~150 mg/mL)で含み,そのSDS-PAGEはヘモシアニンサブユニットのバンドのみを示したので,血リンパをさらに精製することなく結晶化に用いることができた.初期結晶化では複数の条件下で結晶が得られたが,結晶を再溶解して電子顕微鏡観察を行ったところ,十量体構造が保持されていたのは一つの結晶化条件から得られた結晶だけであった.後の解析で,この結晶化条件に含まれているCaCl2がスルメイカヘモシアニンの十量体構造を安定化することがわかったため,我々は,この条件を基に結晶化条件の探索を行った.また,血リンパの個体差が結晶の質に大きく影響したため,100匹を超える生きた個体から採取した血リンパの結晶化スクリーニングを実施した.その結果,ある個体の血リンパから良質な結晶を得ることができ,3.0 Åの分解能のX線回折データを収集することに成功した.Spring-8 BL38B1の顕微分光装置にて結晶の吸収スペクトルを測定したところ,酸素結合型に特有な345 nm付近の吸収を認めたことから,得られた結晶は酸素結合型であると判断した.クライオ電子顕微鏡により決定された腹足類由来ヘモシアニンのCαモデル7)を用いて初期位相を決定し,最終的に28,470残基,80個のCu2O2クラスター,50か所の糖鎖修飾の原子構造を決定した.
スルメイカヘモシアニンの十量体構造は,高さ約160 Å,直径約350 Åの巨大なシリンダー型の会合体で,外壁領域と内部領域に分けられる(図1C).サブユニットは八つのFUから構成されているが(FU-a, -b, -c, -d, -d*, -e, -f, -g)(図1B),外壁領域はFU-a, -b, -c, -d, -e, -fにより構成され,内部領域にはFU-d*, -gの二つが含まれていた(図1D).外壁領域は,上下対称に2回回転対称的に会合した二量体が5回回転対称的に会合した構造(いわゆるD5の対称性)で上下対称であるのに対し,内部領域は円筒の片側に5回対称的に配置しており(C5の対称性)上下非対称な構造をしていた(図1D, E).しかし,興味深いことに,結晶構造解析により得られた電子密度は,外壁領域のみならず内部領域も上下対称なD5の対称性を有していた.そのため,位相決定直後は,内部領域も含めてD5の対称性を持った分子と考えて構造精密化をしていたが,内部領域のFU間に立体障害が生じたことに加え,結晶中では円筒状のヘモシアニンがストローのように積み重なってパッキングしていたことから,得られた結晶構造には上向きの配置と下向きの配置が混在していると結論した(図1E).これらの知見は,結晶のパッキングには外壁領域のみが関与しており,内部領域の構造は結晶中でのヘモシアニンどうしの相互作用には無関係であることを意味している.このような分子パッキングの影響により,外壁領域の電子密度は明瞭であったのに対し,内部領域では電子密度が不明瞭であった.さらに,内部領域を構成するFU-d*については,Cuの異常散乱差フーリエマップをもとに,Cu2O2クラスターの位置だけは決定できたものの,その構造モデルを構築することができなかった(図1D).
次に,10個のプロトマーに注目すると,各々のプロトマーは隣接する五つのプロトマーと相互作用していた(図1C).たとえばプロトマーAはプロトマーB, J, C, I, Dと接触していた.プロトマーB, J, C, Iとは主に外壁領域どうしで相互作用し,プロトマーDとは,内部領域を用いて相互作用していた.2回対称に会合したプロトマーA-Bの二量体は隣接するプロトマーC-D二量体と外壁領域で相互作用する上に,最も離れたプロトマーAとDの内部領域で相互作用することにより,安定な会合体を形成できると考えられる.以上を考え合わせると,内部領域はプロトマー二量体どうしを安定に会合させるためのホチキスのような役割を担っていると推察される.
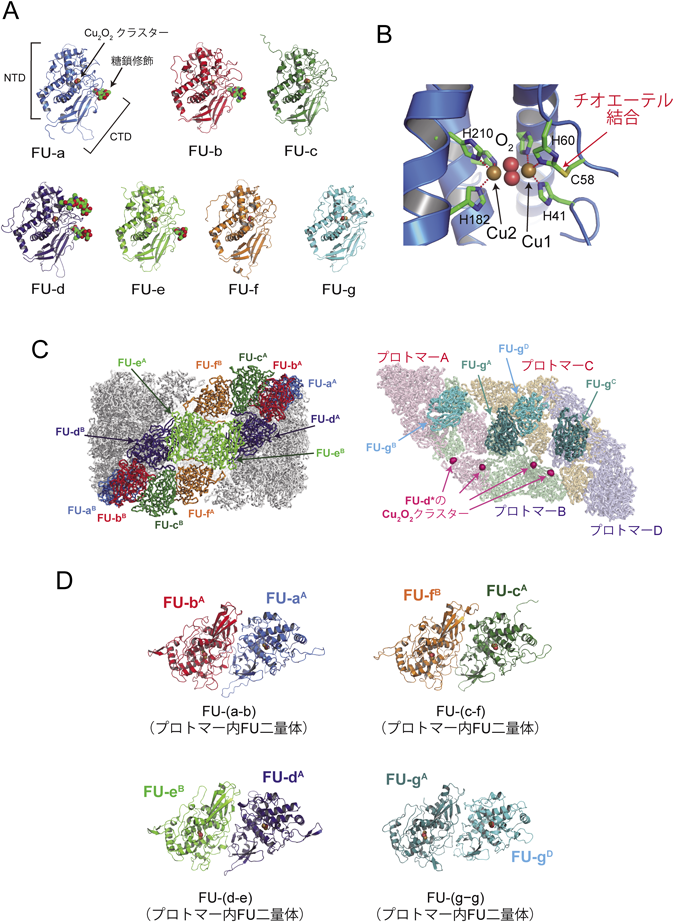
各々のプロトマーを構成する約50 kDaの八つのFU(図1B)は,いずれも,外壁領域,内部領域に関係なく,非常に類似した構造をしていた(RMSDは1.9 Å以下).FUの構造は,主にαへリックスで構成されるN末端ドメイン(NTD)とβ鎖の多いC末端ドメイン(CTD)の二つのドメインから構成されており(図2A),すべてのFUのNTDの中央部に酸素結合部位であるCu2O2クラスターが結合していた.そのため,1分子のヘモシアニンを用い,80個の酸素分子を運搬できることになる.Cu2O2クラスター中に存在する二つのCuイオンは,ともに三つのヒスチジン残基に配位されており,ヒスチジン残基の一つは近傍に存在するシステインとチオエーテル結合という特殊な共有結合を形成していた(図2B).
3.8 MDaにも及ぶ巨大な会合体はいかにして形成されるのか? 本結晶構造から導いたその答えは,すなわち,非常に類似した構造のFUがプロトマー内およびプロトマー間で複雑に会合することで巨大な会合体を形成している,である.
外壁領域には,FU-a, -b, -c, -d, -e, -fの六つのFUが存在していたが,よくみると,FUの二量体が一つの構造単位となり,それらが会合することで外壁領域が構築されていることがわかった.たとえば,FU-aとFU-bは二量体を形成し(以後FU-(a-b)と記載する),同様に,FU-dとFU-e, FU-cとFU-fも類似したFUの二量体を形成していた(それぞれ,FU-(d-e),FU-(c-f))(図2C, D).興味深いことに,これらFU二量体のうち,FU-(d-e)とFU-(c-f)は隣接するプロトマー間(たとえばプロトマーAとB)でドメインスワップされていた.これにより,安定なプロトマー二量体が形成され,それらがさらに会合することで安定な外壁領域が構築できると考えられる.
内部領域では,FU-gどうしがプロトマー間でFUの二量体(FU-(g-g))を形成しており,その構造は外壁領域のFU二量体と非常に類似していた(図2D).これは,外壁領域のみならず内部領域も含めた会合体全体が,FU二量体を一つの構造単位として構築されていることを意味する.FU-(g-g)は遠く離れたプロトマー間の(たとえばプロトマーAとD)ドメインスワップ二量体であり(図2D),外壁領域で二量体化したプロトマーどうしの会合を安定化することで,十量体形成に強く貢献していると考えられる.
以上をまとめると,80個の類似した構造のFUにより形成される巨大会合体ヘモシアニンは,複雑にドメインスワップしながらプロトマー間でFU二量体を形成し,それらがうまく組み上がることでメガダルトンスケールの巨大タンパク質会合体を形成している.
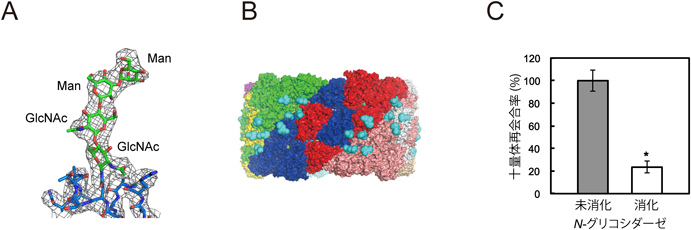
ヘモシアニンには糖鎖修飾の存在が知られており,今回明らかになった構造において,FU-a, -b, -d, -eの四つのFUにN型糖鎖が結合していた(図2A).これらのFUには,CTDの共通する位置に糖鎖が結合しており,FU-dのNTDにはさらに糖鎖が一つ結合していた(図2A).
会合体において,糖鎖はすべて外壁領域の外側に結合しており,それらの結合部位は三つのプロトマー(たとえばプロトマーA, I, Jの位置関係にあるもの)の境界部に密集していた(図3A, B).この糖鎖密集部位は会合体に10か所存在し,1か所あたり五つのN型糖鎖が近接して結合していた.また,N-グリコシダーゼにより糖鎖消化処理すると,十量体への再会合が阻害されたことから,プロトマーどうしの会合に糖鎖が重要であることが明らかになった(図3C).先述のとおり,会合体は,外壁領域においてプロトマーどうしが会合し,プロトマー二量体どうしの会合が内部領域のプロトマー間FU二量体形成により安定化されているが,おそらく糖鎖修飾はこれらの構造を補強する機能を果たしているものと推察される.また,糖鎖修飾のいくつかはヘモシアニンのアロステリック効果に重要な部位に存在していた2, 10).
謝辞Acknowledgments
本研究を推進するにあたり,北海道大学大学院先端生命科学研究院松野明日香氏,田中勲特任教授,姚閔教授,加藤公児助教,北海道立工業技術センター吉岡武也博士,清水健志氏,北海道大学大学院水産科学研究院岸村栄毅教授,東京大学大学院農学生命科学研究科寺田透准教授に大変お世話になりました.本成果は文部科学省創薬支援技術基盤プラットフォーム事業により得られました.
引用文献References
1) Markl, J. (2013) Biochim. Biophys. Acta, 1834, 1840–1852.
2) Kato, S., Matui, T., Gatsogiannis, C., & Tanaka, Y. (2017) Biophys. Rev., doi: 10.1007/s12551-017-0349-4
3) Numoto, N., Nakagawa, T., Kita, A., Sasayama, Y., Fukumori, Y., & Miki, K. (2005) Proc. Natl. Acad. Sci. USA, 102, 14521–14526.
4) Becker, M.I., Arancibia, S., Salazar, F., Campo, M.D., & Ioannes, A.D.(2014) in Immune Response Activation (Duc, G.H.T. ed.), pp. 45–72, InTech, Rijeka, Croatia.
5) Gatsogiannis, C., Moeller, A., Depoix, F., Meissner, U., & Markl, J. (2007) J. Mol. Biol., 374, 465–486.
6) Gatsogiannis, C. & Markl, J. (2009) J. Mol. Biol., 385, 963–983.
7) Gatsogiannis, C., Hofnagel, O., Markl, J., & Raunser, S. (2015) Structure, 23, 93–103.
8) Zhang, Q., Dai, X., Cong, Y., Zhang, J., Chen, D.H., Dougherty, M.T., Wang, J., Ludtke, S.J., Schmid, M.F., & Chiu, W. (2013) Structure, 21, 604–613.
9) Matsuno, A., Gai, Z., Tanaka, M., Kato, K., Kato, S., Katoh, T., Shimizu, T., Yoshioka, T., Kishimura, H., Tanaka, Y., & Yao, M. (2015) J. Struct. Biol., 190, 379–382.
10) Gai, Z., Matsuno, A., Kato, K., Kato, S., Khan, M.R.I., Shimizu, T., Yoshioka, T., Kato, Y., Kishimura, H., Kannno, G., Miyabe, Y., Terada, T., Tanaka, Y., & Yao, M. (2015) Structure, 23, 2204–2212.
11) 松野明日香,田中良和(2016)超巨大タンパク質会合体ヘモシアニンのX線結晶構造解析,日本結晶学会誌,58, 91–95.
著者紹介Author Profile
 加藤 早苗(かとう さなえ)
加藤 早苗(かとう さなえ)鹿児島大学農水産獣医学域水産学系助教.博士(水産学).
略歴北海道生まれ.1994年北海道大学大学院水産学研究科博士後期課程修了.96年理化学研究所国際フロンティア研究員,97年NEDO産業技術研究員,2001年旭川医科大学助手を経て,16年より現職.
研究テーマと抱負ヘモシアニンの会合体形成と酸素運搬能に関する研究.比較生化学的視点からタンパク質の機能と構造の関係を解明したい.
趣味音楽鑑賞(ロック),散歩.
 松井 崇(まつい たかし)
松井 崇(まつい たかし)東北大学大学院生命科学研究科助教.博士(理学).
略歴茨城県生まれ.2007年北里大学大学院基礎生命科学研究科博士後期課程修了.同年三菱化学生命研,09年産総研,10年北海道大学大学院先端生命科学研究院にてポスドク後,12年富山大学和漢研助教を経て,17年より現職.
研究テーマと抱負抗菌標的タンパク質と抗生物質生合成酵素の構造生物学から,薬剤耐性細菌に有効な新規阻害活性分子の発見・創製や阻害機構の解明に貢献したい.
ウェブサイトhttp://www.lifesci.tohoku.ac.jp/labmos/
趣味サッカー観戦(鹿島アントラーズ),ドライブ.
 田中 良和(たなか よしかず)
田中 良和(たなか よしかず)東北大学大学院生命科学研究科教授.博士(工学).
略歴2004年東北大学大学院工学研究科博士課程後期修了.同年北海道大学博士研究員.06年東京大学博士研究員.08年北海道大学テニュアトラック特任助教.12年北海道大学准教授.15年JSTさきがけ兼任研究者.17年より現職.
研究テーマと抱負構造情報に基づいた生体高分子の分子機構の解明とその応用.
ウェブサイトhttp://www.lifesci.tohoku.ac.jp/labmos/index.html
趣味野球,スキー.