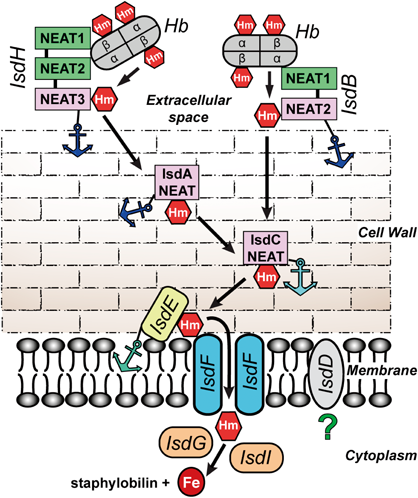
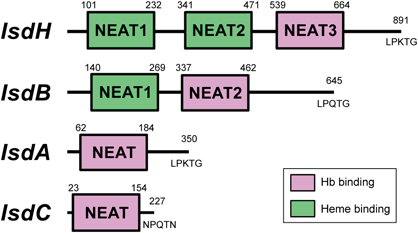
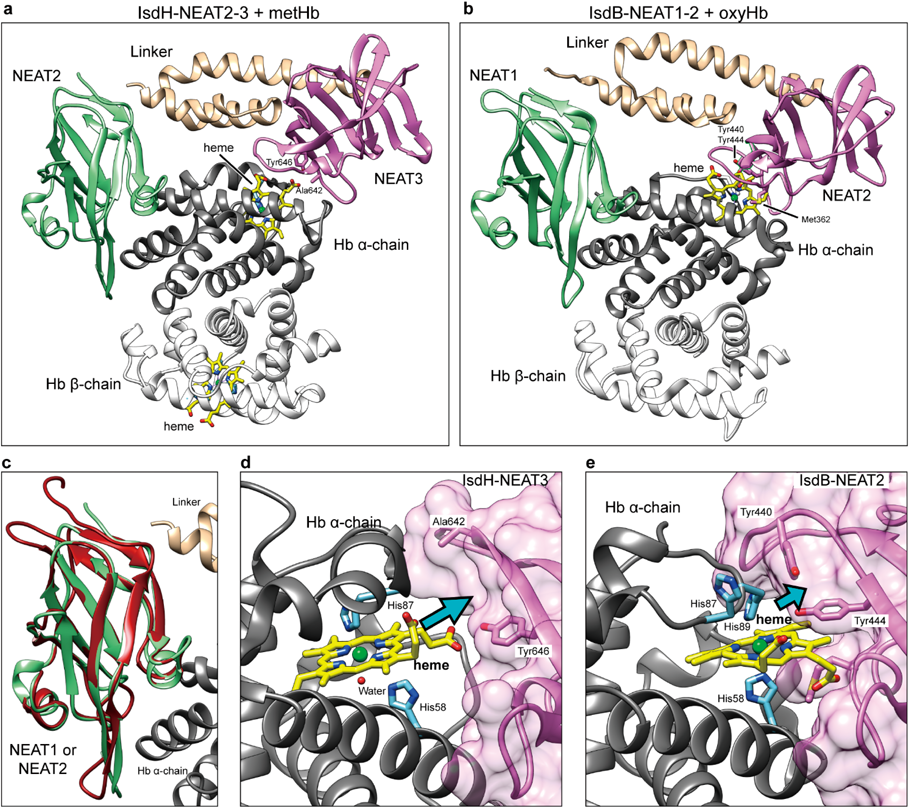
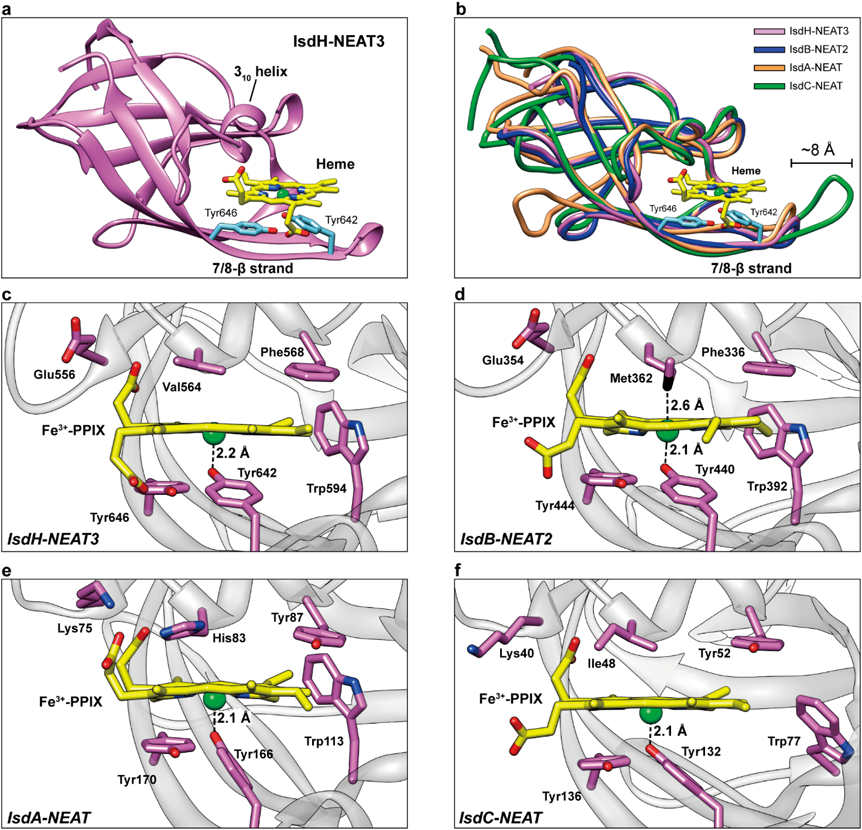
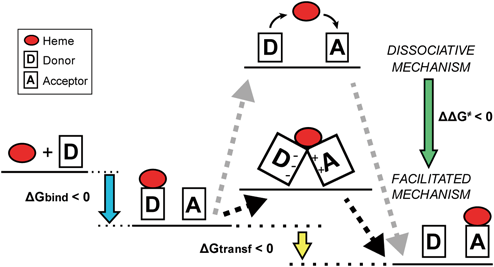
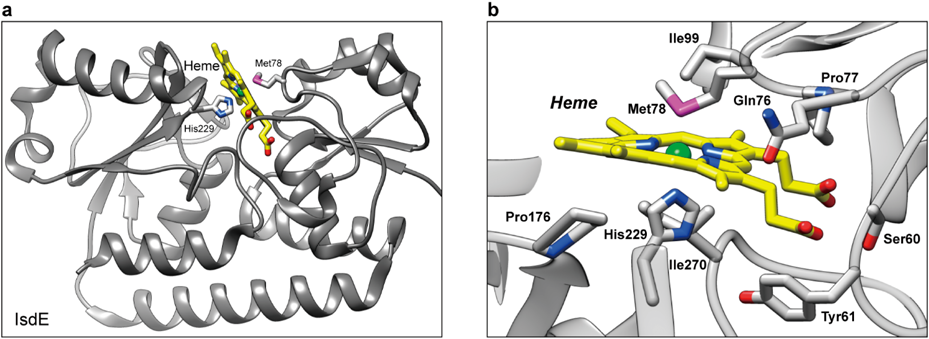
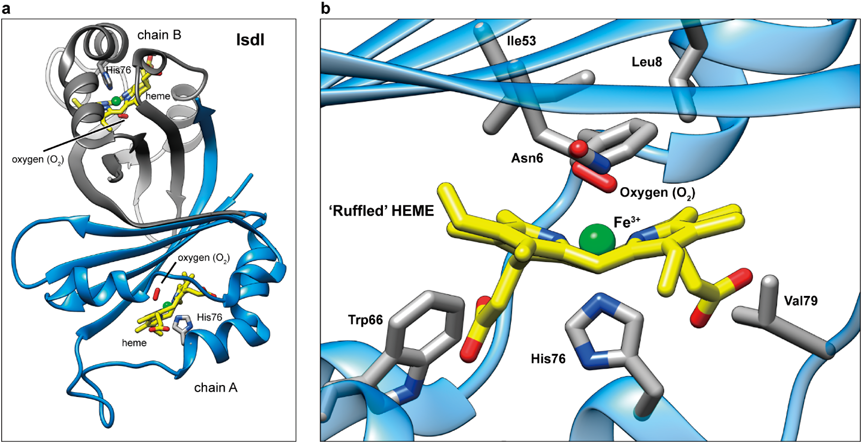
黄色ブドウ球菌の鉄取り込み機構:IsdシステムHeme-acquisition in Staphylococcus aureus by the iron-regulated surface determinant (Isd) system
1 東京大学大学院工学系研究科School of Engineering, The University of Tokyo ◇ 〒113–8656 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–8656, Japan
2 東京大学医科学研究所Institute of Medical Science, The University of Tokyo ◇ 〒108–8639 東京都港区白金台4–6–1 ◇ 4–6–1 Shirokanedai, Minato-ku, Tokyo 108–8639, Japan
3 九州大学大学院薬学研究院Graduate School of Pharmaceutical Sciences, Kyushu University ◇ 〒812–8582 福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan