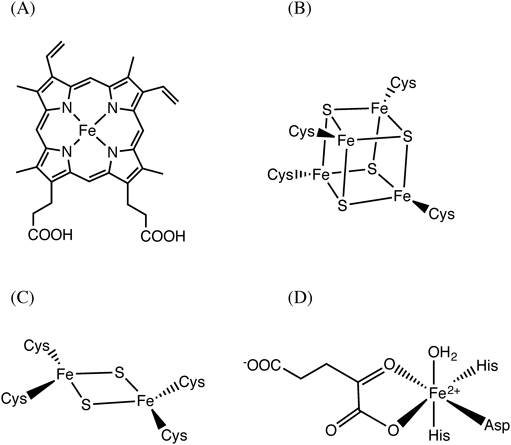
遷移金属イオンは,さまざまな金属タンパク質の活性中心を構成することにより,生体中において多様な生理機能制御に関与している.エネルギー代謝や物質代謝に関与する金属タンパク質は,数多くの例が知られており,古くから研究が行われている.これらに対し,最近では,シグナルセンシング,シグナル伝達に関与する金属タンパク質に関する研究も大きな進展を見せている.これらの金属タンパク質は,アミノ酸のみから構成される単純タンパク質では感知できないシグナル(可視光,O2,CO等の気体分子など)に対応するために利用されている.本稿では,このような遷移金属含有型センサータンパク質の中でも特に気体分子センサータンパク質を取り上げ,図1に示すようなヘム,鉄硫黄クラスター,非ヘム鉄をセンサー素子として利用している代表的な例を中心に紹介する.
1)ヘム含有酸素センサータンパク質1)
Bradyrhizobium japonicum, Sinorhizobium melilotiのような根粒細菌中に存在するFixL/FixJ二成分情報伝達系は,窒素固定化酵素であるニトロゲナーゼの発現を酸素依存的に制御している.本系におけるセンサーキナーゼであるFixLは,N末端領域にPASドメイン(100~120残基のアミノ酸からなり,5本の逆平行βストランドと4本のαヘリックスから構成される構造モチーフであり,タンパク質間相互作用,シグナルセンシング,シグナル伝達等に関与する場合が多い.ヘムやフラビン等の補欠分子族を結合している場合もある),C末端領域にキナーゼドメインを有しており,PASドメインをセンサードメインとして利用している.このPASドメイン中に結合したプロトヘム(図1A)が,酸素センサーの本体として機能している.PASドメイン中に存在するHis残基がヘムの軸配位子として機能しており,酸化型(Fe3+型)およびデオキシ還元型(Fe2+型)FixLでは,ヘムはHisを軸配位子とする5配位構造をとっている1, 2).
FixLの活性は,分子中のヘムに酸素が配位することにより制御されている.デオキシ型FixLは酸素と反応し,ヘムの第6配位座に酸素が結合した酸素化型FixLを生成する.FixJへのリン酸基転移反応によりFixLの活性を測定した場合,酸素化型FixLはデオキシ型FixLの1/100以下の活性しか示さない.このことは,酸素が存在しない場合には,FixLは活性型であるデオキシ型として存在し,レスポンスレギュレーターであるFixJのリン酸化(活性型FixJの生成)が進行するのに対して,酸素存在下ではFixLが不活性型となり,FixJのリン酸化反応が進行しないことを示している.このため,酸素存下ではFixLが不活性型である酸素化型として存在し,FixL/FixJ支配下遺伝子(ニトロゲナーゼ遺伝子)の発現がオフの状態になっているのに対し,根粒細菌中の酸素濃度が低下するとFixLは活性型であるデオキシ型となり,リン酸化FixJが生成することにより,ニトロゲナーゼ遺伝子の発現が開始される.
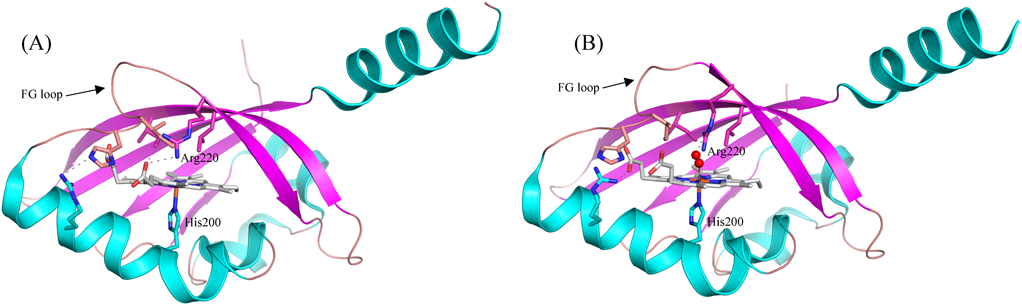
FixL全長の結晶構造は決定されていないが,FixLのセンサードメインの結晶構造を基にした考察から,ヘムに酸素が配位することにより誘起されるヘム周辺のコンホメーション変化が,酸素によるFixLの活性制御の引き金になっていると提唱されている2).FixL中のヘム遠位側(酸素が結合する側)のヘムポケットに存在するループ領域(FGループ)のC末端に位置しているArg220は,デオキシ型ではヘムプロピオン酸基と水素結合を形成している(図2A).FixLの酸素結合に伴って,FGループのコンホメーションが変化し,FGループがヘムポケット内部に近づく.その結果,Arg220とヘムプロピオン酸基の水素結合は解離し,ヘムに結合した酸素とArg220の間で新たに水素結合が形成される(図2B).このような酸素結合に伴うFGループのコンホメーション変化と水素結合ネットワークの再編成が,分子全体のコンホメーション変化を誘起することによりFixLの活性制御が達成されていると考えられる.遠位側ヘムポケット近傍には,いくつかの疎水性アミノ酸残基(Ile209, Leu230, Val232)が密集して存在しており,そのままの状態では立体障害により酸素分子がヘムに結合することができない.したがって,FixL中のヘムに酸素が結合するためには,これら疎水性アミノ酸残基の配置が変化することによる,ヘムポケットのコンホメーション変化が必要となる.このようにして誘起されたヘムポケットのコンホメーション変化も,分子全体のコンホメーション変化に関与することにより,ヘムへの酸素結合に応答したFixLの活性制御が達成されていると考えられる2).
いくつかの細菌では,酸素に対する走化性制御系において,酸素を直接センシングする(酸素センサーとして機能する)走化性シグナルトランスデューサータンパク質(MCPとも呼ばれる.MCPはmethyl-accepting chemotaxis proteinの下線部をとった略称)の存在が報告されている2).枯草菌,高度好塩性古細菌などが有しているHemATは,そのような酸素センサーの代表的な例である.HemATのN末端領域には,酸素センサーとして機能するセンサードメインが,C末端領域には,走化性シグナル伝達タンパク質であるCheA/CheWと相互作用しシグナル伝達に関与するシグナリングドメインが存在している.HemATは,酸素運搬・貯蔵タンパク質であるヘモグロビン・ミオグロビンと相同性を有するグロビンドメインをセンサードメインとして利用している.グロビンドメインをセンサードメインとして利用しているセンサータンパク質は,globin-coupled sensor protein(GCS)と呼ばれ,HemAT以外にも数多く報告されている1, 3).HemATをはじめとするGCSでは,ヘムに配位した酸素と周辺アミノ酸残基間での水素結合ネットワークの形成が,ヘムへの酸素結合(すなわち,酸素センシング)に応答したヘム周辺のコンホメーション変化を誘起し,分子内シグナル伝達により,シグナリングドメインのコンホメーション変化へとつながっているものと推定されている.
HemATは,グロビンドメインをセンサードメインとして利用しているMCPであるが,緑膿菌Pseudomonas aeruginosa中に含まれるMCPの一種であるAer2は,ヘム含有PASドメインをセンサードメインとして利用している.Aer2中のPASドメインは,FixLのPASドメインと類似した構造を示す.Aer2の場合,ヘムに結合した酸素と遠位側ヘムポケットに存在するTrp283との間で形成される水素結合が,分子内シグナル伝達の引き金になっていると推定されている4).
2)ヘム含有COセンサータンパク質5)
COセンサー機能を有する転写調節因子CooAは,紅色非硫黄光合成細菌Rhodospirillum rubrum,一酸化炭素酸化細菌Carboxydothermus hydrogenoformansなどに含まれており,これらの細菌が有しているCO代謝に関与するタンパク質(COデヒドロゲナーゼ,ヒドロゲナーゼ等)の発現を,CO依存的に制御している6, 7).CooAは,構造的にはCRP/FNRファミリーに属しており,N末端領域のセンサードメインとC末端領域のDNA結合ドメインから構成される単量体2分子からなるホモ二量体として存在している.各サブユニットのセンサードメイン中に,それぞれ1分子のプロトヘムを結合している.分子中に結合しているヘムがCOセンサーの本体として機能し,ヘムにCOが結合した場合にのみ,CooAは標的DNAに対する結合活性(転写活性化因子としての活性)を獲得し,標的DNAに結合することで支配下遺伝子の発現を誘導する.分子中のヘムがCO結合型以外の状態にある場合には,CooAは標的DNAに結合できないため,転写調節因子としての活性を示さない.
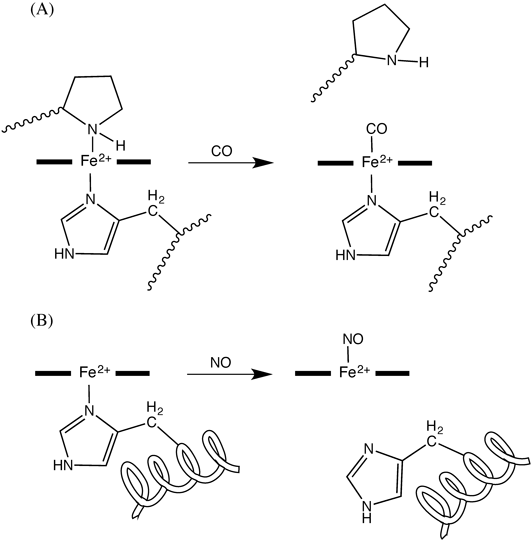
CooA中のヘムは,配位飽和な6配位構造を有しているにもかかわらず,生理条件下において容易にCOと反応し,CO結合型となる.ヘムに配位し,安定な複合体を形成することが知られている酸素は,CooA中のヘムに配位することはない.酸素と還元型CooAを反応させた場合には,安定な酸素結合型CooAが生成することはなく,自動酸化が進行して不活性型CooA(酸化型)が生成する.このような性質は,CO以外の小分子がCooAのエフェクター分子として機能することを防いでいる.NOはCooA中のヘムに結合可能であるが,NOが結合した場合には,ヘムをはさんでNOのトランス位に存在する軸配位子(His)がヘム鉄から解離し,5配位構造をとったNO結合型ヘムが生成する.一方,CO結合型ヘムは,HisとCOが軸配位した6配位構造をとっている(図3A).NOとCOがヘムに結合した場合における配位構造の違いにより,分子全体の構造も両者で異なるため,NO結合型CooAは,転写活性化因子として機能すること,すなわち,NOが生理的なエフェクターとして機能することはない.
還元型ヘムには,Hisと主鎖由来のN末端窒素が軸配位している6, 7).CO結合型CooAが生成する際には,ヘムに配位しているN末端窒素とCOとの間で軸配位子交換反応が進行する.この軸配位子交換反応が,COによるCooA活性化のトリガーとなっていると考えられている.
CooAとは異なる構造を有するCOセンサー機能を有する転写調節因子も報告されている.Burkholderia xenovorans中に含まれるRcoMは,CO結合型においてのみ転写調節因子としての活性を示すという特徴はCooAと同様である.しかしながら,その構造はCooAとは異なっており,PASドメイン,LytTRドメイン(三つの逆平行βシート構造を構成している10本のβストランドと,短い2本のαヘリックスからなるDNA結合ドメイン8))が,それぞれ,センサードメイン,DNA結合ドメインとして機能している5).PASドメイン中には,CooAの場合と同様,プロトヘムが結合している.CooAとRcoMでは,COセンサーとして機能するヘムを結合しているセンサードメインの構造は互いに異なっているが,COによる機能制御機構(特に,COにより転写調節因子として活性化される際の初発反応)は類似している.RcoM中のヘムは,還元型RcoMでは,HisとMetが軸配位した6配位構造をとっているが,生理条件下においてCOと容易に反応し,CO結合型へと変化する.その際,ヘム鉄に軸配位していたMetとCOとの間で軸配位子交換反応が進行する5).COと交換するMetは,PASドメイン中に結合したヘムの遠位(COが結合するサイト)側ヘムポケット周辺に位置するFGループ(FヘリックスとGヘリックスをつなぐループ領域)に存在している.したがって,RcoM中のヘムにCOが結合すると,ヘム鉄に配位していたMetが解離することにより,FGループのコンホメーションが変化し,ヘム周辺から分子全体のコンホメーション変化を誘起することで,COによるRcoMの活性化反応が進行するものと考えられる.
3)ヘム含有NOセンサータンパク質9)
哺乳動物中に含まれる可溶性グアニル酸シクラーゼ(sGC)は,グアノシン三リン酸(GTP)から,セカンドメッセンジャーとして機能するグアノシン3´,5´-環状一リン酸(cGMP)への変換反応を触媒する酵素であり,その酵素活性はNOにより制御されている.配列相同性を有する二つのサブユニット(αサブユニットとβサブユニット)からなるヘテロ二量体構造を有するsGCは,二量体分子中のβサブユニットに1分子のプロトヘムを結合しており,ヘムがNOセンサーの本体として機能している9, 10).休止状態のsGCでは,ヘムは還元型(Fe2+型)として存在しており,His105が軸配位した5配位高スピン構造をとっている.sGC中のヘムにNOが配位することにより,NOがセンシングされる.ヘムにNOが配位すると,sGCの酵素活性は,休止状態の場合に比べて数百倍に活性化される.NOによるsGCの活性化は,NOがヘムに配位することにより誘起されるタンパク質部分のコンホメーション変化によって引き起こされると考えられている.すなわち,sGCとNOが反応すると,ヘム軸配位子であるHis105がヘム鉄から解離し,NOがヘムに結合した5配位型ニトロシルヘムが生成する.軸配位子であるHisがヘムから解離することによって誘起されるコンホメーション変化が,NOによるsGCの活性化を引き起こしていると考えられる10).(図3B)
sGC中のヘムは,外部配位子が配位可能な空配位座を有する5配位型構造であるにもかかわらず,ヘムに酸素が結合することはない.sGCが示す,このようなNOと酸素の結合選択性は,比較的酸素濃度が高い真核細胞中において機能しているsGCが,酸素存在下,NOにより選択的に活性化されるためには必須の性質である.一方,COはsGC中のヘムに配位可能であるが,CO配位によるsGCの活性化はNOの場合ほど顕著ではなく,4~5倍程度の活性化しか観測されない.COがsGC中のヘムに配位した場合には,NOが配位した場合と異なり,軸配位子であるHisがヘムから解離することはなく,sGC中のヘムは,COとHisが軸配位した6配位構造をとる.このため,NOがヘムに配位した場合と,COがヘムに配位した場合では,NO/CO配位により誘起されるヘム周辺(軸配位子であるHisを含むヘムポケット部分)のコンホメーション変化,および分子全体のコンホメーションが互いに異なっているため,活性化の有無が異なるものと考えられる10).
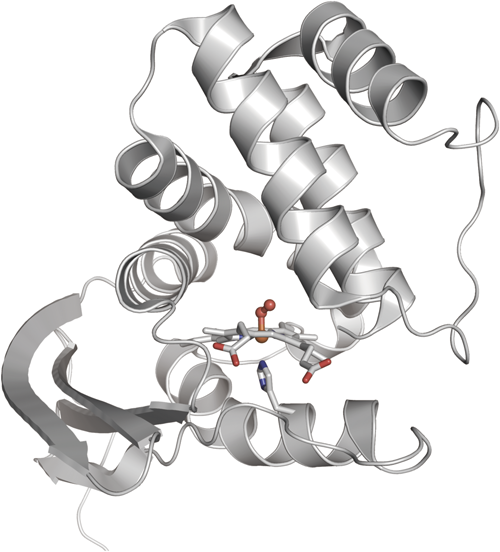
sGCの結晶構造は決定されていないが,原核生物中に含まれ,sGCのβサブユニットと相同性を示すH-NOXドメインの構造がいくつか報告されている.H-NOXには,sGCと同様,NOは結合するが酸素は結合しないものと,NOと酸素のどちらも結合するものが存在している11).後者のタイプであるThermoanaerobacter tengcongensis由来のH-NOX(Tt H-NOX)の酸素結合型は,図4に示すように,7本のαヘリックスと4本の逆平行βストランドから構成されている12).ヘムは,αヘリックスから構成されるサブドメインと,αヘリックスとβストランドから構成されるα/βサブドメインの間にはさまれる形で存在しており,His102がヘムに軸配位しており,そのトランス位に酸素が結合している.Tt H-NOX中では,ヘム近傍に存在するPro115とのファンデルワールス相互作用により,本来平面構造であるはずのヘムが非常に歪んだ構造をとっている.NOがヘムに結合し,ヘムから軸配位子であるHisが解離することにより,ヘムの歪みが解消し,ヘムの平面性が増すことが,NO感知のシグナルとなり,分子内シグナル伝達反応の引き金になっていると推定される.
3. 鉄硫黄クラスターを利用したセンサータンパク質
1)鉄硫黄クラスター含有酸素センサータンパク質13)
これまでに詳細な解析がなされている鉄硫黄クラスター含有センサータンパク質では,[4Fe-4S]クラスター(図1B),あるいは[2Fe-2S]クラスター(図1C)をセンサー本体として利用している例が多い.以下に,その代表的な例について紹介する.
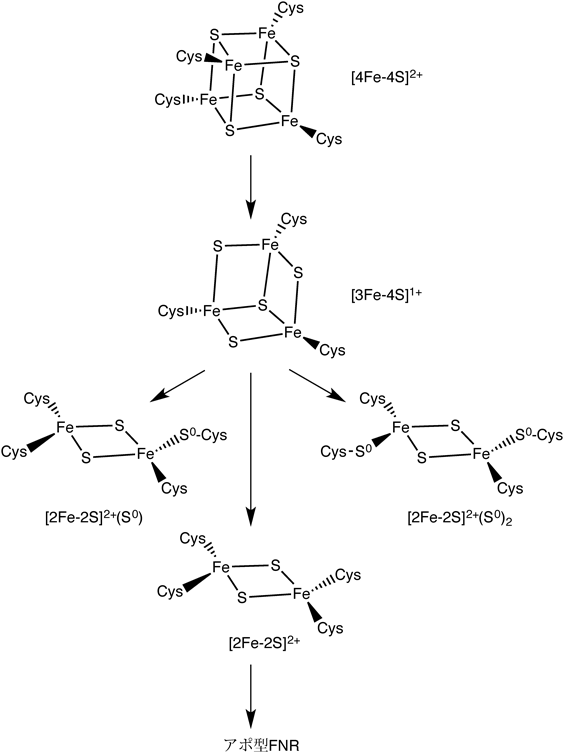
大腸菌に含まれる転写調節因子FNRは,その分子中に含まれる[4Fe-4S]クラスターにより酸素をセンシングし,嫌気代謝と好気代謝を切り替えるためのマスタースイッチとして機能している13).FNRは,CooAと同様,CRP/FNRファリミーに属する転写調節因子である.ホロ型FNRは,Cys20, Cys23, Cys29, Cys122が配位した[4Fe-4S]クラスターが,N末端センサードメイン中に保持されたホモ二量体構造を有している.ホロ型FNRは,標的DNAに対する特異的DNA結合能を有しており,転写調節因子としての活性を示す.一方で,酸素センシングの結果生成するアポ型FNRは,単量体へと構造変化し,転写調節因子としての活性(特異的DNA結合能)を失う.
FNRによる酸素センシングにおいては,FNR中の[4Fe-4S]クラスターと酸素との反応により,図5に示すような鉄硫黄クラスターの骨格変換反応が進行する13).休止状態において[4Fe-4S]2+の酸化状態にあるクラスターが酸素と反応することで,鉄硫黄クラスター骨格からFe2+が解離するとともに,[3Fe-4S]1+クラスターが生成する.生成した[3Fe-4S]1+クラスターは,不安定中間体であり,ここからさらにFe3+と2分子のS2−が解離し,[2Fe-2S]2+クラスターが生成する.このようにして生成した[2Fe-2S]2+クラスターも酸素に対して不安定であり,酸素存在下において分解反応が進行し,アポ型FNRへと変化する.
[3Fe-4S]1+クラスターから解離したS2−は,S0に酸化された後,システイン側鎖と反応することにより過硫化物を形成し,[2Fe-2S]2+クラスターに配位することが報告されている.FNRと酸素を反応させたサンプルの質量分析(ESI-MS)により,[2Fe-2S]クラスターに1分子および2分子のシステイン過硫化物が配位した[2Fe-2S]2+(S0)および[2Fe-2S]2+(S0)2の生成が観測されている13).[4Fe-4S]クラスターの骨格構造変化が起こる際には,Cys20が最初に鉄硫黄クラスターから解離することにより,鉄硫黄クラスターに配位している三つのCys(Cys20, Cys23, Cys29)が存在するループ部分(CRP/FNRファミリー中でFNRのみに存在する特徴的なN末端ループ)のフレキシビリティーが増大し,鉄硫黄クラスター骨格構造変化を促進していると考えられている.
ブドウ球菌(Staphylococcus属細菌)における硝酸塩呼吸遺伝子群の発現制御に関与するNreBにおいても,FNRと同様なクラスター骨格構造変換反応が進行することが報告されている14).センサーキナーゼであるNreBは,レスポンスレギュレーターであるNreCとともに二成分情報伝達系を構成している.NreBは,センサードメインとして機能するPASドメインを有している.PASドメイン中には,システイン4残基(Cys59, 62, 74, 77)が配位した[4Fe-4S]2+クラスターが存在しており,この[4Fe-4S]2+クラスターが酸素センサーとして機能している.NreBは,嫌気条件下においては,[4Fe-4S]2+クラスターを結合したホロ型として存在している.ホロ型NreBは,自己リン酸化活性を有する活性型であり,NreCへのリン酸基転移反応による活性型NreC生成を触媒し,標的遺伝子の発現が制御される.NreBによる酸素センシングにおいてもFNRと同様,[4Fe-4S]2+クラスターと酸素との反応により,まず[4Fe-4S]クラスターから[2Fe-2S]クラスターへの骨格変換反応が進行し,最終的にはアポ型NreBが生成する.このようなクラスター骨格構造変換により,NreBは不活性型へと変化する.
黄色ブドウ球菌S. aureus中に含まれるAirS/AirR二成分情報伝達系におけるセンサーキナーゼであるAirSは,GAFドメイン(PASドメインと類似した立体構造を有している)をセンサードメインとして利用しており,GAFドメイン中に酸素センサーとして機能する[2Fe-2S]クラスターを有している14).この[2Fe-2S]クラスターは,[2Fe-2S]1+と[2Fe-2S]2+の間で可逆的な酸化還元反応が進行する.[2Fe-2S]2+の状態にある酸化型AirSが活性型であり,自己リン酸化およびAirRリン酸化活性を示す一方で,鉄硫黄クラスターが[2Fe-2S]1+に還元された還元型では活性を示さない.AirSによる酸素センシングは,還元型AirSが酸素と反応することにより,分子中の鉄硫黄クラスターが酸化されることで,活性型へと変化することによると考えられている.本系では,鉄硫黄クラスターの骨格構造変化ではなく,可逆的な酸化状態変化が機能制御に重要な役割を果たしているが,その詳細な制御機構については不明な点が多く残されており,今後の研究が待たれる.
2)鉄硫黄クラスター含有NOセンサータンパク質13)
Streptomyces coelicolor, Bacillus subtilis等が有しているNsrRは,Rrf2ファミリーに属し,NOをエフェクターとする転写調節因子である.NsrRは,ホモ二量体として存在しており,各サブユニット中にNOセンサーとして機能する[4Fe-4S]クラスターを有している13, 14).NsrR中の[4Fe-4S]クラスターには,3残基のCysと1残基のAspが配位している.S. coelicolor由来のNsrRについては,その結晶構造が報告されており,鉄硫黄クラスターに配位しているCys残基(Cys93, 99, 105)とAsp残基(Asp8)は,異なるサブユニット由来であることがわかっている.
NsrRは,ホロ型([4Fe-4S]クラスター結合型)のみが特異的DNA結合能を有しており,リプレッサーとして機能する.ホロ型NsrRがエフェクター分子であるNOを感知すると,NOと[4Fe-4S]クラスターとの反応が進行し,鉄ニトロシル錯体が生成する.本反応では,単一の鉄ニトロシル錯体が生成するのではなく,構造が異なる複数([Fe2(NO)4(Cys)2],[Fe2(NO)2(Cys)2],[Fe4(NO)7S3]など)の錯体が生成すると考えられている.NOと[4Fe-4S]クラスターとの反応により,NsrRのDNA結合能は完全に失われる.その結果,NsrRのリプレッサーとしての機能が失われることで,その支配下遺伝子(NO解毒に関与するタンパク質をコードしている)の発現が誘導される.本系においても,鉄硫黄クラスターの骨格構造変化が,NsrRの機能制御に重要な役割を担っていると考えられる.
1)非ヘム鉄含有酸素センサータンパク質15)
HIF-1(hypoxia inducible factor 1)は,哺乳動物の低酸素応答制御において中心的な役割を果たしている転写調節因子である.HIF-1の活性は,HIF-1 αサブユニット(HIF-1α)中に存在するPro残基,あるいはAsn残基の翻訳後修飾(水酸化)の有無により制御されている15).この翻訳後修飾は酸素依存的な反応であり,α−ケトグルタル酸(αKG)依存性オキシゲナーゼの一種であるHIF水酸化酵素(プロリン水酸化酵素,アスパラギン水酸化酵素)が関与している.通常濃度の酸素存在下(normoxia)においては,HIF水酸化酵素によるPro, Asnの水酸化反応が進行し,Pro残基が水酸化されたHIF-1αはプロテアソームにより分解されることにより,またAsn残基が水酸化されたHIF-1αは,転写活性な複合体を形成するのに必要なp300との結合が阻害されることにより,それぞれ転写因子としての活性を失う15).一方,低酸素状態(hypoxia)においては,これらの水酸化反応が進行せず,HIF-1αが転写因子としての活性を示す.(式1)に示すように,HIF水酸化酵素による反応においては,酸素分子が反応基質として利用されるため,細胞中の酸素濃度に依存してHIF-1αの翻訳後修飾の有無が決定されることになる.すなわち,HIF水酸化酵素が酸素センサーとして機能して,HIF-1αの活性を制御しているといえる.
HIF水酸化酵素による水酸化反応は,以下に述べるような反応機構で進行する15).酵素の活性中心として機能するFe(II)は,休止状態においては,図1Dに示すように,2残基のHis, 1残基のAsp, 1分子の水,および2座配位した1分子のαKGが配位した6配位構造を有している.基質であるHIF-1αが酵素に結合すると,水分子がFe(II)から解離し,代わりに酸素分子がFe(II)に配位する.その後,αKGの酸化的脱炭酸反応が進行する一方で,酵素活性中心ではFe(IV)=O種が活性反応中間体として生成し,HIF-1αの水酸化反応を触媒する.HIF水酸化酵素では,酸素に対するMichaelis定数が,生理的な酸素濃度よりも十分に大きな値を示す.このことは,酵素活性が酸素濃度に比例して変化することを意味しており,HIF水酸化酵素が生理条件下において酸素センサーとして機能することを担保している.
2)非ヘム鉄含有NOセンサータンパク質15, 16)
大腸菌,Cupriavidus necator(旧名:Ralstonia eutropha)等が有しているNorRは,NOをエフェクターとして機能制御される,σ54依存型転写調節因子である.そのN末端には,センサードメインとして機能するGAFドメインが,C末端にはDNA結合ドメインがあり,両ドメイン間にAAA+ドメイン(N末端α/βサブドメインとC末端αヘリカルサブドメインから構成されるサブユニットが,リング状の六量体を形成するATPaseファミリーと相同な構造を示すドメイン)が存在している.GAFドメイン中に結合したFe2+がNOセンサー(NO結合サイト)として機能している.NorRの構造,およびNorR中に結合したFe2+の配位構造は決定されていないが,1残基のArgおよびCysと,Asp(単座配位が2残基,二座配位が1残基)が配位した6配位子構造が提案されている17).NorRによるNOセンシングにおいては,GAFドメイン中のFe2+に1分子のNOが結合したモノニトロシル錯体が生成すると考えられている.この際,Fe2+に配位しているアミノ酸残基とNOとの間で配位子交換反応が進行すると考えられるが,その詳細については明らかではない.NO非存在下においては,GAFドメインとAAA+ドメイン間でのドメイン間相互作用により,NorRはσ54と相互作用できない不活性型コンホメーションを取っており,AAA+ドメインのATPase活性は抑制されている.GAFドメイン中のFe2+にNOが結合することにより,GAFドメインとAAA+ドメイン間のコンホメーション変化が誘起され,AAA+ドメインのATPase活性が発現するとともに,NorRとσ54が複合体を形成し,NorRが転写活性化因子としての活性を獲得する18).
ガス分子センサータンパク質においては,遷移金属イオン,あるいは遷移金属含有補欠分子族が,センサー機能発現に必要不可欠な役割を果たしている.本稿で紹介したように,センサーとして機能する活性中心やセンサードメイン,および,これらのセンサータンパク質により制御される生理機能は多様性に富んでおり,それらの構造や機能についても不明な点が多く残されている.特に,センサータンパク質全長の構造情報が得られているケースは少なく,今後の研究の進展が期待される.
引用文献References
1) Sawai, H. & Shiro, Y. (2018) in Gas Sensing in Cells (Aono, S. ed.), pp.47–83, Royal Society of Chemistry, London.
2) Gilles-Gonzalez, M.A. & Gonzalez, G. (2005) Heme-based sensors: defining characteristics, recent developments, and regulatory hypotheses. J. Inorg. Biochem., 99, 1–22.
3) Walker, J.A., Rivera, S., & Weinert, E.E. (2017) Mechanism and Role of Globin-Coupled Sensor Signalling. Adv. Microb. Physiol., 71, 133–169.
4) Sawai, H., Sugimoto, H., Shiro, Y., Ishikawa, H., Mizutani, Y., & Aono, S. (2012) Structural basis for oxygen sensing and signal transduction of the heme-based sensor protein Aer2 from Pseudomonas aeruginosa. Chem. Commun. (Camb.), 48, 6523–6525.
5) Aono, S.(2018) in Gas Sensing in Cells (Aono, S. ed.), pp. 84–135, Royal Society of Chemistry, London.
6) Aono, S. (2003) Biochemical and biophysical properties of the CO-sensing transcriptional activator CooA. Acc. Chem. Res., 36, 825–831.
7) Roberts, G.P., Kerby, R.L., Youn, H., & Conrad, M. (2005) CooA, a paradigm for gas sensing regulatory proteins. J. Inorg. Biochem., 99, 280–292.
8) Sidote, D.J., Barbieri, C.M., & Stock, A.M. (2008) Structure of the Staphylococcus aureus AgrA LytTR domain bound to DNA reveals a beta fold with an unusual mode of binding. Structure, 16, 727–735.
9) Williams, D.E., Fischer, J.T., Heckler, I., & Boon, E.M.(2018) in Gas Sensing in Cells (Aono, S. ed.), pp. 15–46, Royal Society of Chemistry, London.
10) Derbyshire, E.R. & Marletta, M.A. (2012) Structure and regulation of soluble guanylate cyclase. Annu. Rev. Biochem., 81, 533–559.
11) Plate, L. & Marletta, M.A. (2013) Nitric oxide-sensing H-NOX proteins govern bacterial communal behavior. Trends Biochem. Sci., 38, 566–575.
12) Pellicena, P., Karow, D.S., Boon, E.M., Marletta, M.A., & Kuriyan, J. (2004) Crystal structure of an oxygen-binding heme domain related to soluble guanylate cyclases. Proc. Natl. Acad. Sci. USA, 101, 12854–12859.
13) Jason, C.C. & Le Brun, N.(2018) in Gas Sensing in Cells (Aono, S. ed.), pp.136–178, Royal Society of Chemistry, London.
14) Unden, G., Nilkens, S., & Singenstreu, M. (2013) Bacterial sensor kinases using Fe-S cluster binding PAS or GAF domains for O2 sensing. Dalton Trans., 42, 3082–3087.
15) Chaplin, V.D., Barbato, A.N., & Knapp, M.J.(2018) in Gas Sensing in Cells (Aono, S. ed.), pp. 219–252, Royal Society of Chemistry, London.
16) Ishimori, K. & Nam, D.(2018) in Gas Sensing in Cells (Aono, S. ed.), pp. 179–218, Royal Society of Chemistry, London.
17) Tucker, N.P., D’Autréaux, B., Yousafzai, F.K., Fairhurst, S.A., Spiro, S., & Dixon, R. (2008) Analysis of the nitric oxide-sensing non-heme iron center in the NorR regulatory protein. J. Biol. Chem., 283, 908–918.
18) Spiro, S. (2007) Regulators of bacterial responses to nitric oxide. FEMS Microbiol. Rev., 31, 193–211.
著者紹介Author Profile
 青野 重利(あおの しげとし)
青野 重利(あおの しげとし)自然科学研究機構生命創成探究センター・分子科学研究所教授.工学博士.
略歴1982年東京工業大学工学部卒業,87年同大学院博士課程修了,日本学術振興会特別研究員,ジョージア大学博士研究員,東京工業大学助手,北陸先端科学技術大学院大学助教授を経て,2002年より現職.
研究テーマと抱負遷移金属が関わるシグナルセンシングおよびシグナル伝達の分子機構解明.
ウェブサイトhttps://groups.ims.ac.jp/organization/aono_g/