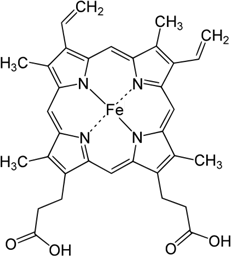
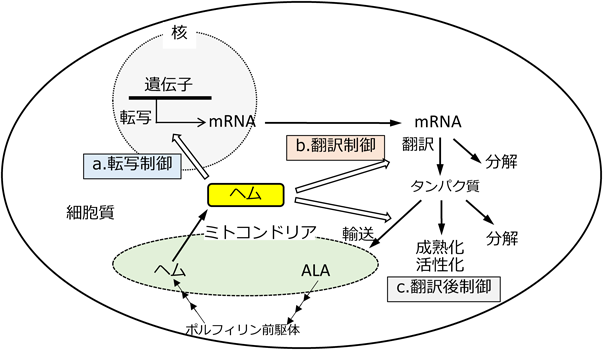
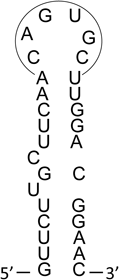
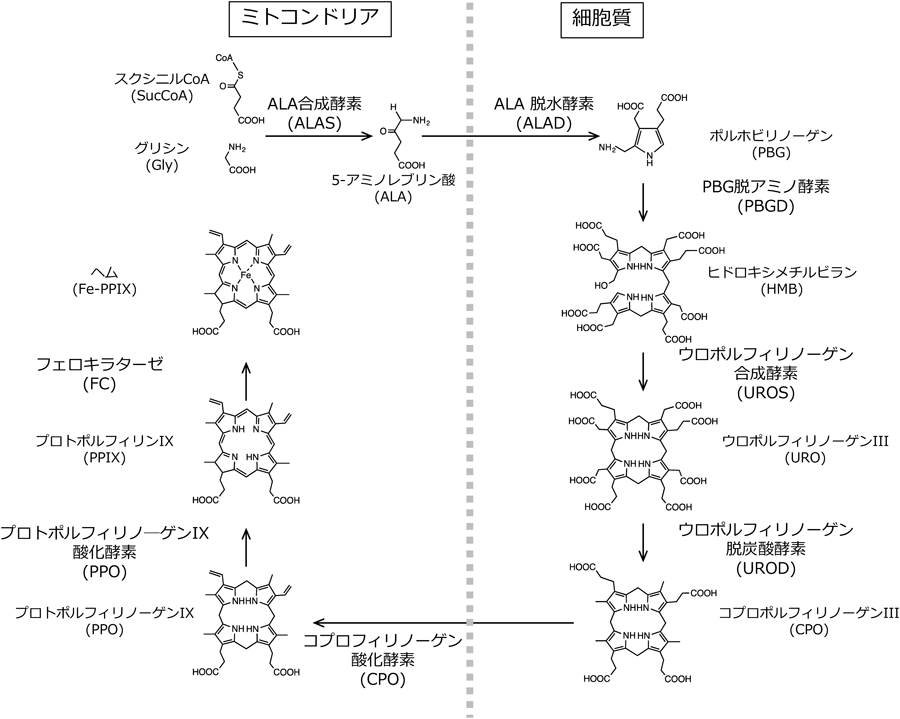
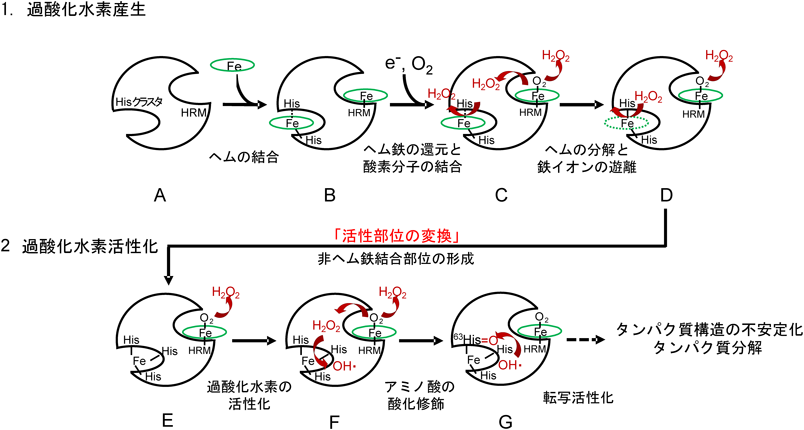
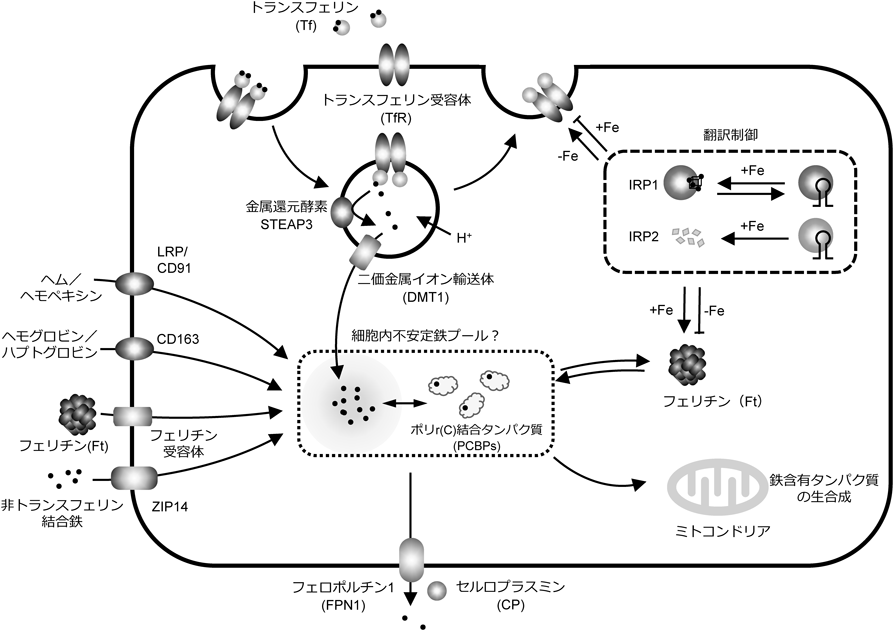
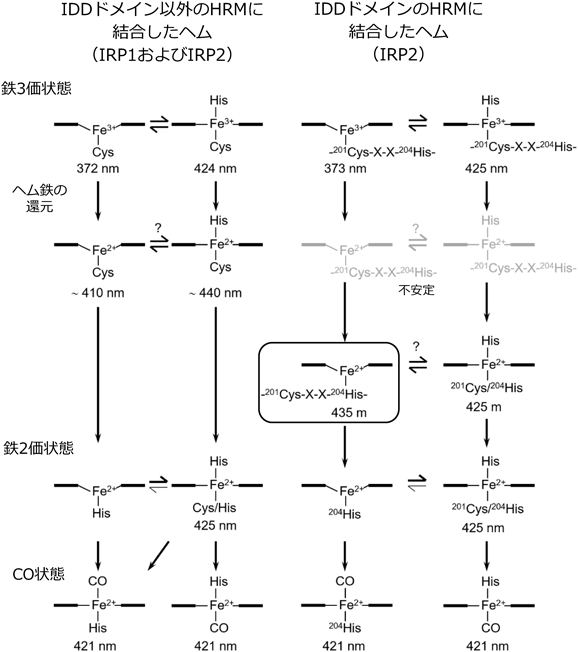
ヘムを生体内シグナル伝達分子として利用する制御タンパク質の構造と機能Functional and Structural Characterization Regulator Protein Using Heme as a Signaling Molecule in vivo
北海道大学大学院理学研究院化学部門Department of Chemistry, Faculty of Science, Hokkaido University ◇ 札幌市北区北10条西8丁目 ◇ Kita 10, Nishi 8, Kita-ku, Sapporo 060–0810, Hokkaido, Japan