銅(copper,原子番号29,元素記号Cu)はすべての生体において必要な金属である.植物・動物のいずれでも,銅の過不足は健全な成長を妨げる.ヒトにおいても,銅は必須微量元素の一つである.これは,生体内にセルロプラスミン,スーパーオキシドジスムターゼ(superoxide dismutase:SOD),シトクロームcオキシダーゼなど多くの銅要求酵素が存在するためである.胎児で銅が欠乏した場合は発育障害や貧血,神経障害などが起こる.また,銅はタンパク質と結合していない遊離の状態では毒性を発揮するため,過剰になっても生体に障害を生じる.
銅は食事や飲み物より消化管にて吸収される.1日約2~5 mgの銅が経口摂取され,約2 mgが胃,十二指腸ならびに小腸上部から吸収される1).この銅吸収は,ATP7Aタンパク質により行われる.吸収された銅は門脈から肝臓へ運ばれ,約5%は全血中に流入し,約10%はセルロプラスミン結合銅として血液中に再度出現する1).セルロプラスミン結合銅は血液中の銅の約95%を占める.銅の主な排泄経路は胆汁であり,1日約2 mgが排泄される1).また,極微量ではあるが尿あるいは汗からも排泄される.唾液や胃液などからも排泄され,一部は上部消化管から再吸収される.肝臓から胆汁中への銅の排泄と,肝細胞内での銅とセルロプラスミンとの結合は,ATP7Bタンパク質により行われている.
1)概念・病態
Wilson病は,常染色体劣性遺伝形式をとる先天性銅代謝異常症の代表的疾患である.原因遺伝子は,染色体13番長腕13q14.3に位置するATP7B遺伝子である.この遺伝子から産生されるATP7Bタンパク質は,銅の肝細胞内から胆汁中への排泄と,活性型セルロプラスミンタンパク質の合成過程における銅の供給を行っていると考えられている.Wilson病の病態の中心は,肝臓から胆汁中への銅の排泄障害による肝細胞中への銅蓄積である.肝細胞内に取り込まれた銅は胆汁中へ排泄されずに蓄積していく.それらの銅はメタロチオネインと結合して,無毒化されて貯蔵される.しかし,貯蔵閾値を超えたときには銅イオンとヒドロキシラジカルなどのフリーラジカルが出現する.それらがSODなどの活性酸素消去能を超えると肝障害が生じる.さらに肝臓から血中に放出された非セルロプラスミン銅は,大脳基底部,角膜および腎臓などに蓄積してそれらの臓器障害を引き起こす.
2)疫学
本邦におけるWilson病の発症頻度は出生35,000~45,000人に1人と推定されている2).発症のピークは10~11歳ごろであるが,発症年齢は3歳から50歳代と幅広く分布している2).
3)臨床症状・所見
Wilson病における臨床症状の中心は,肝障害による症状と神経症状である.また,角膜周囲の銅沈着によって生じるKayser-Fleischer角膜輪は本症に特徴的な診察所見である.その他に,精神症状や腎障害などを呈する症例もみられる.肝障害の症状としては,易疲労感,黄疸,下腿浮腫などの非特異的な症状の出現頻度が高い3).その他に腹水や出血傾向を認める場合もある.何ら自覚症状がなく,血液検査での肝酵素が異常値を示すのみの場合も少なくない.また,意識障害と溶血を伴い急速に肝不全が進行する症例(劇症肝炎型症例)も全体の4~7%程度に認められる.神経症状は錐体外路症状が中心である.構音障害,歩行障害,羽ばたき振戦などが高い頻度にて認められる4).他に知能障害やジストニアなどもみられる.幼児期以降の急性・慢性の肝障害,および学童期以降の神経あるいは精神症状をみたときは,本症は必ず疑うべきである.
4)診断
Wilson病を疑ったときの特殊検査は,血清セルロプラスミン値測定および尿中銅排泄量測定である.尿中銅は,可能な限り1日尿中銅排泄量を測定する.眼科的にKayser-Fleischer角膜輪を検索することも重要である.さらなる特殊検査としては,肝銅含量の測定とATP7B遺伝子解析がある.血清セルロプラスミン値低下(20 mg/dL以下)と尿中銅排泄量増加(100 µg/日あるいは1.5 µg/kg/日以上)を認めれば,本症と診断して治療を開始してよいと考える5).ただし,本症の約5%に血清セルロプラスミン値正常例が存在することと,4歳以下の幼児では尿中銅排泄量が有意に上昇していない症例が多くみられることには注意が必要である.肝銅含量の増加はWilson病における最も特異的な検査所見であり,200 µg/g wet tissueあるいは250 µg/g dry tissue以上という著明な高値を示す.これを確認できればWilson病と診断を確定することが可能である.また,ATP7B遺伝子解析にて両方のallele(対立遺伝子)に変異を同定できれば,やはり診断を確定することができる.特に年少例や家族内検索では有用な確定診断法である6, 7).しかし,Wilson病であっても遺伝子解析にて変異が同定できない症例が10%程度存在する8).そのため,遺伝子解析にて変異が同定できなくても,本症を否定することはできない.
5)治療
Wilson病は,治療法が確立されている数少ない遺伝病の一つである.銅キレート薬あるいは亜鉛薬による薬物療法が行われている.銅キレート薬は,血液中の銅と結合して尿中に排泄させる.亜鉛薬は,腸管からの銅吸収を阻害する.また,銅の摂取制限(低銅食)も同時に行う.肝不全に陥った症例に対しては肝移植が適応となる.
本邦においては,銅キレート薬としてD-ペニシラミンと塩酸トリエンチン,そして亜鉛薬として酢酸亜鉛が用いられている.重症例に対しては,銅キレート薬と亜鉛薬の併用も行われている.
6)予後
Wilson病は,早期から適切な治療が行われれば十分な社会復帰あるいは発症の予防が可能である.逆に,発症から診断・治療開始までに時間がかかると,肝臓あるいは中枢神経に不可逆的変化が生じ,治療を行っても各臓器の機能が十分に回復しないこととなる.また,銅キレート薬あるいは亜鉛薬による治療は生涯継続する必要がある.Wilson病患者の中には,治療が奏功して通常の日常生活を送っていたにもかかわらず,怠薬のため症状が再燃し,治療困難となったり死亡したりした例が認められる.良好な服薬コンプライアンスを保つことがきわめて重要である.
3. Wilson病診療の今後の課題,MC-Bank患者登録からみた日本人Wilson病患者の実態に関する検討
1)研究目的
本邦におけるWilson病症例の実態,長期的・社会的予後およびQOLなど包括的医療情報を得て本疾患の診断および治療・管理に役立てることを目的として,先天代謝異常症臨床情報バンク(MC-Bank)を通じて本症の患者登録を行った.今回筆者は,登録された患者データの一部に対して集計と検討を行った.
2)対象および方法
筆者の教室にて過去に行ったWilson病全国調査の方法と成績をもとに,調査対象ならびに調査項目の検討を行い,患者登録シートの作成を行った.登録シートは,Wilson病の患者ならびに家族の会である「ウイルソン病友の会」の事務局から会員へ郵送した.シートは,患者自身あるいは保護者に記入していただくこととした.登録シートの回収は各会員からMC-Bank事務局への郵送で行った.
今回の解析では,発症年齢,現在の年齢,現在の症状・状態,転帰,困り感や不安の有無ならびに感じている問題点に関して検討を行った.
3)登録シートの配布と回収
「ウイルソン病友の会」事務局より294の登録シートが配布され,140シートが回収された.回収率は47.6%であった.
4)発症年齢と現在の年齢
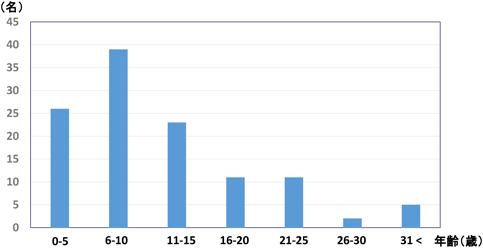
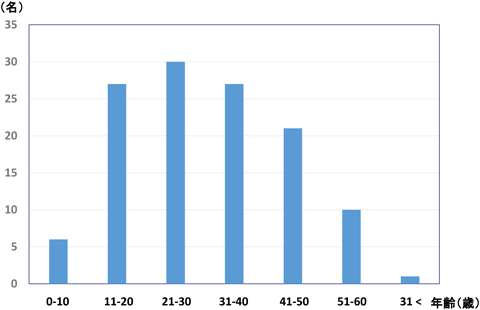
発症年齢は2歳から42歳であった.発症のピークは6~10歳であり,平均発症年齢は12.1歳であった(図1).今回登録を行った症例の現在の年齢は6歳から62歳であり,平均年齢は30.1歳であった(図2).過半数が成人であった.
5)現在の症状と転帰
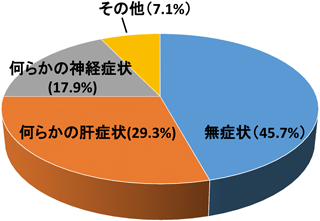
64例(45.7%)の症例が無症状であった.何らかの肝症状あるいは肝機能障害を有する症例は41例(29.3%),何らかの神経症状を有する症例が25例(17.9%)であった(図3).
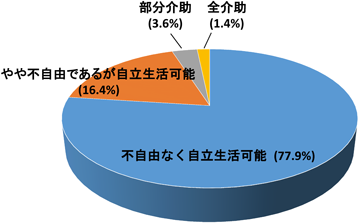
転帰では,日常生活で「すべてにおいて不自由なく自立生活可能」な症例が109例(77.9%)であり,「やや不自由であるが自立生活可能」な症例が23例(16.4%)であった(図4).「部分介助」が必要な症例が5例(3.6%),「全介助」を必要とする症例が2例(1.4%)みられた(図4).
6)困り感や不安の有無と感じている問題点
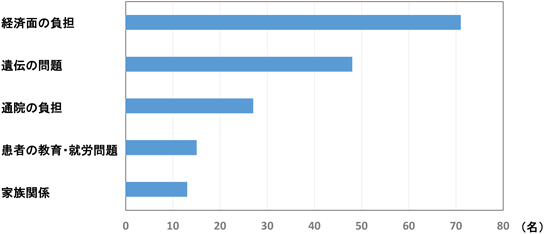
登録シートでの「困っていることや不安に思っていることは何か?」との質問に対し,118例(84.3%)の症例あるいは保護者が何らかの不安や困難さを感じていると回答した(図5).その内容としては,経済面や遺伝に関しての不安を訴える症例や保護者が多くみられた(図6).また,保護者が記載したシートでは,Wilson病患者である子どもが独り立ちした後の服薬コンプライアンスの維持など病気の管理についての不安も多く記載されていた(図6).高齢の症例では,定期的な通院が負担であるとの記載もみられた(図6).
7)結果のまとめ
- ・ウイルソン病の発症年齢は幅広いが,平均発症年齢は12.1歳であり小児期発症が多い.
- ・しかし,登録を行った症例の現在の年齢は平均30.6歳であり,過半数の患者が成人であった.
- ・本症患者の転帰は比較的良好であるものの,同時に84.3%の患者あるいは保護者が何らかの不安や生活の困り感を感じていた.
8)Wilson病診療の今後の課題(今回の調査からわかったこと)
今回の調査においてもWilson病の発症年齢は2歳から42歳と幅広く分布していたが,平均発症年齢は12.1歳であり小児期の発症が多いことが確認された.小児科の医師が診断して治療を開始することが多い疾患であるといえる.しかし,今回登録を行った本症症例の現在の年齢は平均30.1歳であり,過半数が成人であった.これら成人症例を小児科の医師がそのままみるのか,あるいはどこかで内科等の医師に受け渡すのか,もしそうであれば移行の時期や何科に診療を依頼すべきかなどを検討していく必要がある.この「移行期医療」は,今後のWilson病診療の重要な課題である.
また,日常生活では90%以上の症例が自立生活可能なことより,医学的見地からはWilson病の予後(転帰)は良好といえる.しかし,同時に80%以上の患者・保護者が何らかの不安や生活の困り感を感じていた.特に医療費等の経済的不安や,次子への遺伝に関する不安を訴える回答が多くみられた.今後のWilson病診療は,患者の健康状態のみならず,生活の質を含めた包括的な管理と,生活上の不安や困り感に対する対応も必要であると考えられた.
謝辞Acknowledgments
「MC-Bank患者登録からみた日本人Wilson病患者の実態に関する検討」は,厚生労働科学研究費補助金,難治性疾患等克服研究事業「小児希少難病の患者家族会ネットワークを活用した患者臨床情報バンクの構築とその創薬等への活用(H24-難治等(難)-一般-017) 」の分担研究として行った.研究代表者である国立成育医療研究センター臨床検査部の奥山虎之先生ならびにMC-Bank事務局(現JaSMIn事務局)の徐朱玹先生に深謝するとともに,調査にご協力いただいた「ウイルソン病友の会」の会員の皆様に心より感謝いたします.
引用文献References
1) 青木継稔(2004)遺伝性銅代謝異常症の臨床とその分子病態,Biomed Res Trace Elements, 15, 307–315.
2) Aoki, T., Suzuki, M., Fujioka, Y., Shimizu, N., Fuji, H., Nakazono, H., Kawase, C., Yamaguchi, Y., Arashima, S., Matsuda, I., et al.(1996) in Neonatal and Perinatal Screening, the Asian Pacific Perspective, p.25–28, The Chinese University Press, Hong Kong.
3) 清水教一(2015)小児神経学の進歩,44, 109–115.
4) 清水教一,鈴木真理子,山口之利,青木継稔,松田一郎,有馬正高(1996)全国調査からみた神経型・肝神経型Wilson病の臨床像および肝銅含量に関する検討,脳と発達,28, 391–397.
5) 藤井秀樹(1997)発症前Wilson病のセルロプラスミンおよび銅代謝に関する研究,診断基準作成の試み,Biomed Res Trace Elements, 8, 75–83.
6) Shimizu, N., Nakazono, H., Watanabe, A., Yamaguchi, Y., Hemmi, H., & Aoki, T. (1997) Molecular diagnosis of Wilson’s disease Lancet, 349, 1811–1812.
7) Shimizu, N., Takeshita, Y., Watanabe, A., Hemmi, H., Shimatake, H., & Aoki, T. (2005) Molecular diagnosis for presymptomatic patients with Wilson disease Biomed Res Trace Elements, 16, 315–317.
8) Nakamura, H., Hemmi, H., & Shimizu, N. (2009) Molecular Diagnosis of Wilson Disease in Japanese Patients J. Med. Soc. Toho, 56, 65–70.
著者紹介Author Profile
 清水 教一(しみず のりかず)
清水 教一(しみず のりかず)東邦大学医療センター大橋病院小児科教授.医学博士.
略歴1958年3月東京都に生まれる.83年3月東邦大学医学部卒業.83年6月東邦大学医学部付属大橋病院にて研修.85年6月東邦大学医学部小児科学研究室研究生.87年10月国立精神・神経センター武蔵病院小児神経科レジデント.90年1月東邦大学医学部小児科学第2講座研究生.同年2月Washington University School of Medicine, Department of Pediatrics, research associate(St. Louis, USA).93年3月東邦大学医学部小児科学第2講座助手.95年12月同講師.2011年3月同准教授.18年2月東邦大学医学部小児科学講座(大橋)教授.現在に至る.
研究テーマと抱負研究テーマは先天性銅代謝異常症Wilson病の基礎ならびに臨床研究です.Wilson病の病態や発症機序のさらなる解明とWilson病患者様のより良い生活のために奮闘しています.
ウェブサイトhttp://www.lab.toho-u.ac.jp/med/ohashi/ped/
趣味ドッグスポーツ(特にアジリティ).