分子状酸素(O2)を活性化して,有機分子の酸素化反応(oxygenation)をつかさどる酵素(一原子酸素添加酵素,モノオキシゲナーゼ)としては,ポルフィリン鉄錯体を含むヘム酵素(P450など)と,タンパク質のアミノ酸側鎖に直接結合した鉄イオンや銅イオンを活性中心とする非ヘム金属酵素が知られている1).これらの金属酵素では,金属に結合したO2に電子を注入して還元的に活性化し,高い酸化能を有する金属–活性酸素錯体(スーペルオキシド,ペルオキシド,ヒドロペルオキシド,オキシドなど)を発生させ,酸化剤として用いている.これらの酵素はホルモンの合成,神経伝達物質の代謝,毒物の分解,メラニン色素の合成など,生体内における重要な酸化反応過程に関与している.本稿では,銅を含む一原子酸素添加酵素(銅含有モノオキシゲナーゼ)による「酸素分子の活性化機構」に絞って解説する.
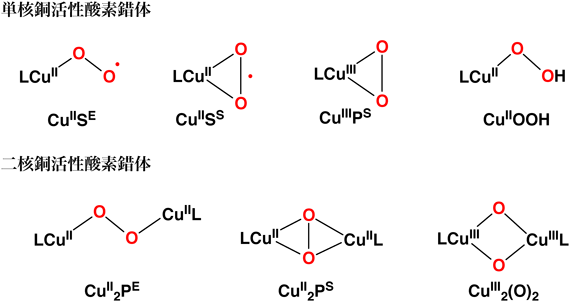
銅含有酸化酵素に含まれる反応活性種の構造,分光学的・磁気的特性,および反応性に関する詳細な情報を提供するため,シンプルなモデル錯体を用いた研究が活発に行われてきた(合成生物無機化学).これまでに構造が明らかにされている単核および二核の銅–活性酸素錯体を図1に示した2–4).
銅(I)錯体がO2と反応すると,酸素が一電子還元されて生じる単核銅(II)-スーペルオキシド錯体が得られる.この場合,酸素分子が銅(II)イオンにend-on型で結合したもの(CuIISE)とside-on型で結合したもの(CuIISS)がある.また,O2が形式的に2電子還元されて生成する単核銅(III)-ペルオキシド錯体(CuIIIPS)が得られる場合もある.このようにして生成した単核の銅–酸素錯体は,多くの場合,溶液中に存在するもう1分子の銅(I)錯体と反応して,ペルオキシド架橋二核銅(II)錯体を与える.この場合にも,ペルオキシド基がend-on型に結合したもの(CuII2PE)とside-on型に結合したもの(CuII2PS)がある.さらにここからペルオキシド基が各銅(II)イオンから1電子ずつ受け取り(還元され),酸素–酸素結合が均等開裂(homolysis)すれば,二つのオキシド基で架橋された高原子価二核銅(III)錯体[CuIII2(O)2]となる.一方,単核銅(II)-スーペルオキシド錯体が水素原子(または電子とプロトン)を受け取ると,単核銅(II)-ヒドロペルオキシド錯体(CuIIOOH)となる.このような銅–活性酸素錯体の生成は,用いる配位子Lの構造(配位数,立体構造,電子ドナー性,置換基の立体障害など)によって精密に制御されている.さらに,単核銅(II)-ヒドロペルオキシド錯体(CuIIOOH)の酸素–酸素が開裂して生じる銅(II)-オキシラジカル種(CuIIO•)や銅(III)-オキシラジカル種(CuIIIO•)も反応活性種として提唱されているが,これらの生成を溶液中で直接とらえた例は,まだ報告されていない.
図1に示した銅–活性酸素錯体については,結晶構造,電子構造,分光学的・磁気的特性などの詳細が明らかにされている5).また,基本的な反応性についても検討が行われ,酵素反応機構に対して重要な情報を提供してきた.以下,代表的な銅含有一原子酸素添加酵素(銅モノオキシゲナーゼ)の反応について,我々の最近の成果も交えて簡単に紹介する.
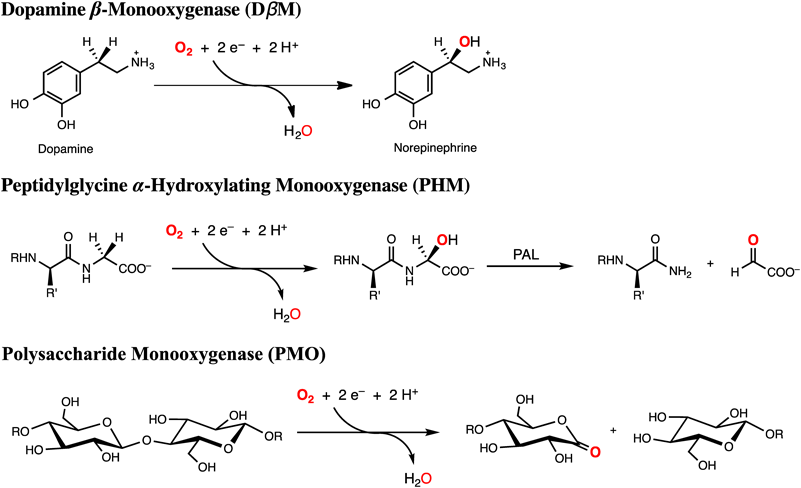
活性中心に一つの銅イオンを含む酵素の代表的なものとしては,dopamine β-monooxygenase(DβM, EC 1.14.17.1),peptidylglycine α-hydroxylating monooxygenase(PHM, EC 1.14.17.3),lytic polysaccharide monooxygenase(LPMO)などが知られている.これらの酵素はそれぞれ,ドーパミン(神経伝達物質)やペプチドホルモンの酸化的変換反応,および多糖類の酸化的分解反応をつかさどっている(図2).いずれの場合もO2の還元的活性化によって生成する単核銅–活性酸素種を用いてsp3炭素のC–H結合を酸化している5).
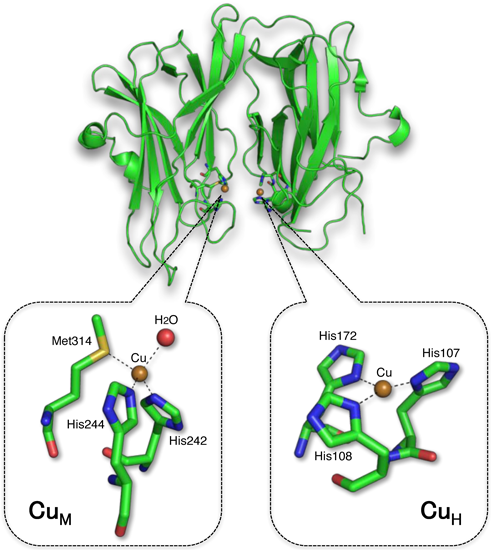
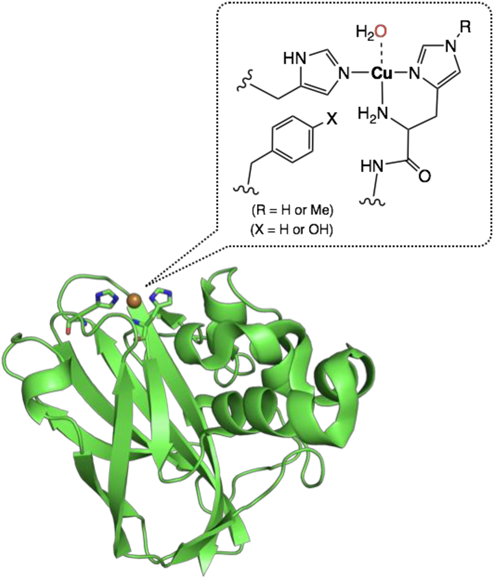
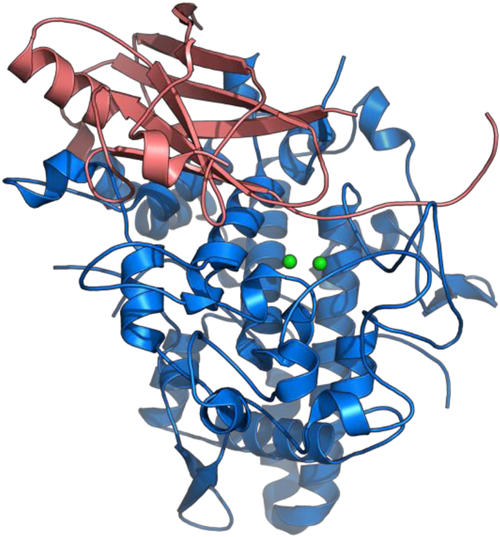
Amzelらによって報告されたPHMのresting state(休止状態)の結晶構造を図3に示した.CuHおよびCuMと呼ばれる単核の銅サイトが二つあり,CuHでアスコルビン酸などの還元剤から電子を受け取り,これをCuMに渡してO2の還元的活性化を行っている.二つの銅サイトは約11 Å離れており,直接的な相互作用はない.前者は,二つのヒスチジンのイミダゾール基と一つのメチオニンのスルフィド基で保持された銅イオンに水分子が配位してゆがんだ四面体構造をとっている.一方,後者は三つのヒスチジンのイミダゾール基が配位したゆがんだ平面三角構造を有している6).DβMも同じような構造であることが最近に明らかにされた7).
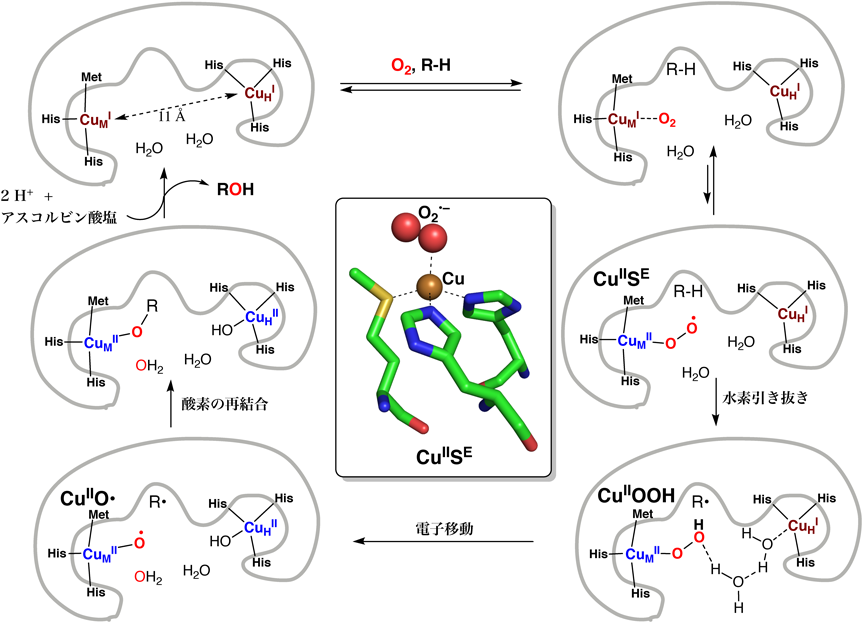
これまでに,速度論的検討や計算化学を用いた検討から,図1に示したような単核銅–活性酸素種を含むさまざまな反応機構が提唱されてきた.図4には,Klinmanらによって提唱されている反応機構を示す8).二つの銅イオンが一価の状態(還元型)にあるPHMに基質とO2が結合し,CuM上で銅(II)-スーペルオキシド種(CuIISE)が生成する.Klinmanらが行った,酸素の同位体を用いた詳細な速度論的検討によると,このスーペルオキシド種が基質から直接水素を引き抜き,銅(II)-ヒドロペルオキシド種(CuIIOOH)と基質のラジカル中間体(R•)が生成する.この段階で,CuHサイトから溶媒の水分子を経由してもう1電子が供給され,CuIIOOHのO–O結合が開裂し,銅(II)-オキシラジカル種(CuIIO•)が生じる.これが基質のラジカル中間体(R•)と再結合してアルコールが生成する.したがって,PHMの反応では,銅(II)-スーペルオキシド種(CuIISE)が基質のC–H結合の活性化を行っている.Amzelらは,酸素結合型PHMの構造解析にも成功し,四配位四面体型構造を持つスーペルオキシド種(CuIISE)の存在が示唆された(図4の中心に示した図)9).
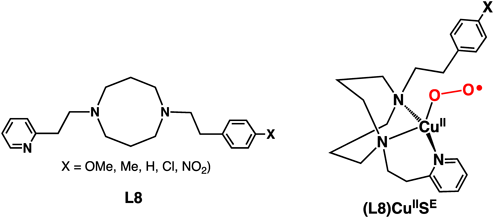
このような反応機構を検証するため,モデル系においてさまざまな配位数と配位構造を有する単核銅–酸素錯体(図1)が合成され,それらの構造や反応性について検討されてきた10).中でも伊東らが報告した単核銅(II)-スーペルオキシド錯体(L8)CuIISEは,酵素系に含まれる活性種の構造や反応性を非常によく再現するモデルとして注目されている(図5)11).
この錯体は,八員環の環状ジアミンにピリジルエチル基を導入したシンプルな三座配位子L8を用いて調製した銅(I)錯体とO2との反応により生成する(図5右).共鳴ラマンスペクトル,紫外可視吸収スペクトル,電子スピン共鳴(EPR)スペクトル,密度汎関数理論(DFT)計算を用いた検討,および同じ配位子を用いて調製した銅(II)-塩化物錯体の結晶構造との比較などから,この錯体は酵素系で見いだされたような四配位のゆがんだ四面体構造を有していることがわかった(図5右).このスーペルオキシド錯体は,397 nm(ε=4200 M−1 cm−1),570(850),705(1150)に特徴的な吸収バンドを示し,O–O結合の伸縮振動は1033 cm−1に観測されて,18O2を用いた場合,968 cm−1にシフトしたことから,スーペルオキシド錯体であることが確認された.また,EPRの詳細な検討結果から,三重項の基底状態を有することが判明した11, 12).
このスーペルオキシド錯体は,アミン窒素に導入したフェネチル基のベンジル位の水酸化反応を誘起する11, 12).フェネチル基の置換基Xの電子的効果やアルキル側鎖部分を重水素でラベル化した配位子を用いた速度論的重水素同位体効果などの結果から,スーペルオキシドによるベンジル位の水素引き抜きが律速段階に含まれていることがわかった12).この反応機構はDFT計算の結果によっても支持された12).このような反応は,図2に示したDβMのモデル反応とみなすことができ,図4に示したKlinmanらの反応機構を支持する結果である.
非常に安定なセルロールやキチンを分解する酵素であるLPMOの活性部位にも単核の銅中心が存在することが明らかにされた(図6)13).この場合,銅イオンは二つのヒスチジンのイミダゾール基とN末端のアミノ基が配位した三配位構造(Histidine-braceと呼ばれている)となっており,近傍にフェニルアラニンあるいはチロシンのベンゼン環またはフェノール基が存在している.この場合にもスーペルオキシドCuIISEやヒドロペルオキシドCuIIOOHに相当すると思われる酸素付加体の構造が結晶中で確認されているが,反応機構の詳細は不明である14).計算化学などを用いた検討の結果から,単核銅–オキシラジカル種CuIIO•の関与も示唆されている14).
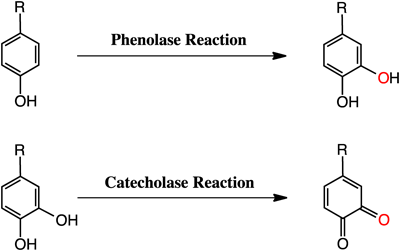
活性中心に磁気的に相互作用可能な二核の銅サイト(タイプ3銅)を含む代表的な金属タンパク質には,フェノールの酸素化反応(phenolase反応)やカテコールの酸化反応(catecholase反応)をつかさどるチロシナーゼ(tyrosinase)がある(図7).これらの反応はメラニン色素の生合成の初期過程であり,side-on型に結合したペルオキシド基が架橋した二核銅(II)錯体CuII2PSが酸化活性種となっている.同じような二核の銅中心は,軟体動物や節足動物の体内で酸素の運搬や貯蔵をつかさどっているヘモシアニン(hemocyanin)や,多くの植物に存在し,カテコールの酸化反応(catecholase反応)を触媒するカテコールオキシダーゼ(catechol oxidase)にも含まれている.
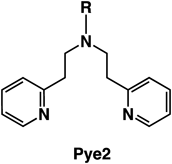
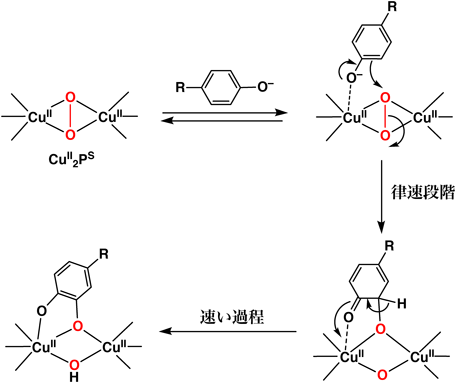
伊東らは,Pye2系の三座配位子(R=−CD2Ph,図8)の銅(I)錯体とO2との反応によって生成するside-on型のペルオキシド二核銅(II)錯体(Pye2)2CuII2PSと各種パラ置換フェノラート誘導体のリチウム塩(p-X-C6H4OLi;X=tBu, Me, Br, Cl, F, COMe, COOMe)との反応を低温の嫌気性条件下,アセトン中で検討したところ,良好な収率(60~90%)で対応する酸素化生成物であるカテコール誘導体が得られることを見いだした15, 16).この反応では,フェノキシルラジカルのカップリング二量体は生成しなかった.さらに,重酸素を用いた同位体標識実験から,基質に導入された酸素は分子状酸素由来のものであることが確かめられた.詳細な反応速度論的検討を行ったところ,反応速度は基質の濃度に対してMichaelis-Menten型の飽和依存性を示し,Hammettのρ値は−1.8で,フェノラートの芳香族水素を重水素に置き換えた場合にも一次同位体効果(KIE~1)が認められないことがわかった.このような結果から,フェノラートの水酸化反応は,図9に示したように,ペルオキシド錯体に基質のフェノラート酸素が配位して会合体を形成した後,会合体内でペルオキシド基の酸素が基質の芳香族環を求電子的に攻撃して反応が進行していると提唱された(芳香族求電子置換反応機構)15, 16).その後,類似のモデル錯体を用いたフェノラートとの反応がいくつかの研究グループにより検討され,伊東らが提唱した芳香族求電子置換反応で進行することが確かめられた.
モデル研究で明らかとなった反応機構が,酵素系の反応に適用可能かどうかを調べるため,伊東らは,実際の酵素(マッシュルームのチロシナーゼ)を用いて検討した.その結果,酵素系の反応においても,モデル反応の場合と同様の速度論的挙動(Hammettのρ値は−2.4,速度論的一次同位体効果KIE=1)が得られたことより,酵素系の反応も,モデル系の場合と同様に芳香族求電子置換反応機構(図9)で進行することが証明された17).
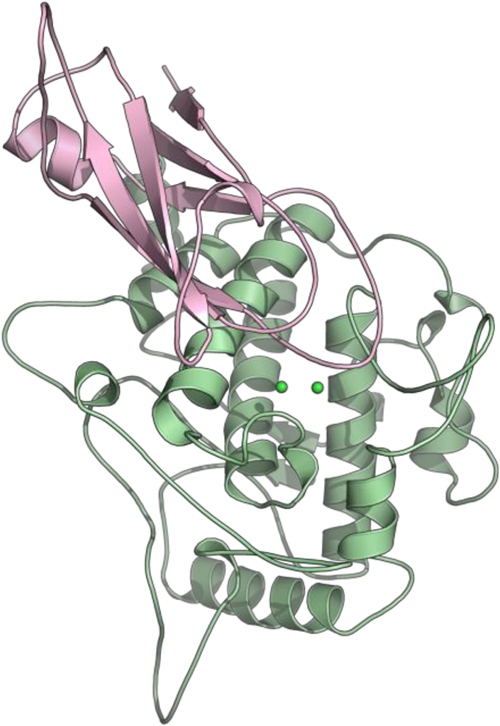
筆者らは最近,同じ菌類であるコウジ菌から得られたチロシナーゼのDNAを大腸菌の遺伝子に組み入れて発生させた組換え体の結晶構造解析に成功した18).この組換え体はほとんど酵素活性を示さず,酸素付加体であるCuII2PSの状態で安定に存在する.これはC末端側に存在するドメイン(図10のピンク色で示した部分)が,酵素の活性中心を覆い隠し,基質の取り込みが阻害されているためである.
結晶構造を基に,C末端ドメインの役割を検討したところ18, 19),C末端には,銅の運搬や取り込みに関与する銅シャペロンに共通のアミノ酸配列-Cys-X-X-Cys-が存在し,銅の取り込みにおいて重要な役割を果たしていることが示唆された.このことは,これらのシステインをアラニンに変えた変異体を用いた銅の取り込み実験からも支持された18).また,C末端部位に存在するフェニルアラニン側鎖(Phe513)のベンゼン環が二核銅活性中心の基質結合部位に貫入し,外部からの基質の接近を妨げていることも確かめられた.事実,コウジ菌由来の組換え体チロシナーゼをトリプシンのような加水分解酵素で処理すると,マッシュルームチロシナーゼと同等の高い触媒活性を示した20).この活性型チロシナーゼの結晶構造では二核銅のうち,N末端側のヒスチジン残基が配位する銅イオン(CuA,他方をCuBとする)に由来する電子密度が,約2 Å離れた位置に二つ観測された.一つはHis67, His94, His103が配位し,もう一つはHis67とHis94と新たに水分子が配位していた.L-チロシンとの複合体結晶構造では後者の銅とフェノール部位が配位していることがわかり,銅イオンが移動しながら反応する可能性が示唆されている.
興味深いことに,コウジ菌由来の組換え体の構造は,タコ由来の酸素運搬タンパク質であるヘモシアニンの一つの活性ユニットの構造と非常に近いことがわかった(図11)21).この場合にも,二核銅中心のあるコアドメインに加えて,ピンク色で示したC末端ドメインが存在する.ヘモシアニンのオキシ体(酸素結合型)にはチロシナーゼと同様のCuII2PSが含まれているが,触媒活性は示さない.これは,二核銅中心がC末端ドメインで保護されているためである.一方,ヘモシアニンを加水分解酵素やアニオン性の界面活性剤,あるいは尿素のようなタンパク質の変性剤で処理すると酸化活性を示すようになることが以前からわかっていたが,これはC末端ドメインが何らかの構造変化を起こして,二核銅中心への入り口が開放されて基質が接近できるようになるためであると考えられる22).二核銅中心を有する銅タンパク質には共通のCuII2PSが含まれているが,これらの機能(O2の可逆的吸脱着,phenolase反応,catecholase反応)は,活性中心を取り巻くタンパク質の構造の違いにより制御されていることがよく理解できる.
4. メタン酸化酵素(膜結合型メタンモノオキシゲナーゼ)
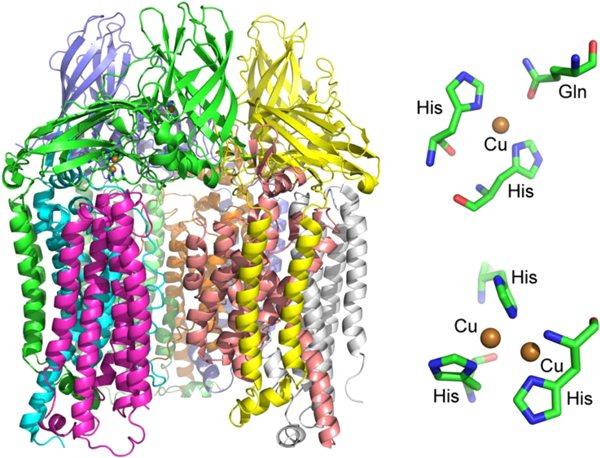
メタンのような不活性なC–H結合(105 kcal/mol)を活性化してメタノールへと変換する反応は,石油に変わる天然ガスの有効利用などの観点から最近特に注目を集めている.このような反応をつかさどる酵素として,メタン資化生菌に含まれるメタンモノオキシゲナーゼ(methane monooxygenase:MMO)が知られている.MMOには水に可溶性のもの(soluble methane monooxygenase:sMMO)と,膜結合型のもの(particulate methane monooxygenase:pMMO)がある.sMMOでは,二核の鉄活性中心においてO2の活性化とメタンの酸化が達成されており,反応機構についてもかなりの部分が明らかにされている23).一方,pMMOに関しては長年構造が不明であったため,反応機構の詳細は不明であった.最近になってRosenzweigらにより結晶構造が明らかにされ,単核と二核の銅活性中心が存在することが明らかにされた(図12)24, 25).
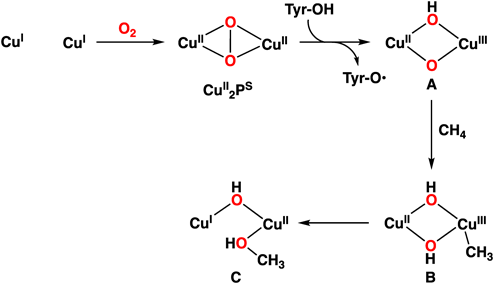
現時点では,二核銅サイトが活性中心として有力視されているが26, 27),単核や三核の可能性も提案されている28, 29).pMMOの反応機構についても計算化学を用いた研究がいくつか報告されているが,図13には結晶構造を基にして計算した吉澤・塩田らの反応機構を示す30).二核の銅(I)サイトにO2が反応し,ペルオキシド架橋二核銅(II)中間体CuII2PSが生成する.これが,近傍に存在するチロシンにより1電子還元とプロトン化を受け,オキシドとヒドロキシドで架橋された混合原子価Cu(II)Cu(III)中間体Aとなる.これが活性種となりメタンと反応し,メチル基が一方の銅(III)イオンと結合した中間体Bを与え,ここから一方のヒドロキシド基と銅に結合したメチル基が結合して生成物Cとなる.
以上,本稿では,単核および二核の銅活性中心を有する銅含有モノオキシゲナーゼによる分子状酸素の活性化機構について概説した.銅(I)イオンに結合した酸素に金属を介して電子を注入し,図1に示したような活性酸素錯体が生成し,それらによって基質の酸化反応が進行する.酸素添加反応では基本的に二つのパターンが存在する.脂肪族(sp3)炭素の場合には,活性酸素錯体によってC–H結合が切断され,生じた炭素ラジカルに酸素原子が結合することで酸素化反応が進行する(hydrogen atom abstraction and oxygen rebound mechanism).最初のC–H結合切断の段階は,形式的には水素原子(H•)の引き抜きで進行するが,電子とプロトンが移動するプロトン共役電子移動(proton-coupled electron transfer)機構で進行する場合もある.この段階については,銅–活性酸素錯体のみならず,さまざまな遷移金属–活性酸素錯体を用いて,C–H結合の強さ(bond dissociation energy:BDE)と反応速度の相関関係や,活性酸素錯体の塩基性と還元電位との関係などの観点から詳細に検討が行われている31).一方,芳香族の水酸化については,活性酸素種による芳香族環への求電子攻撃を鍵とする芳香族求電子置換反応機構で進行する.したがってこの場合には活性酸素錯体の求電子性や還元電位,ならびに生成する付加中間体の安定性などが反応速度を決める重要な因子となる.
最後に,本稿では取り上げなかったが,quercetin-2,4-dioxygenase(2,4-QD)やアミン酸化酵素におけるTOPA quinone補欠分子(2,4,5-trihydroxyphenylalanineのキノン型酸化体)の生合成過程などにも,単核銅活性中心で分子状酸素による有機分子の酸素化反応が含まれている5).しかし,これらの反応においては酸素分子が直接有機分子と反応し,銅イオンは有機基質を活性化する役割を担っている.
本稿で紹介した銅含有モノオキシゲナーゼの反応機構に関してはまだまだ不明な点も多く残されており,今後,酵素学的検討に加えてモデル化学的研究や計算化学的検討により,さらに詳細な反応機構の解明が可能になるものと確信する.そのような研究から得られた情報は,生体機構の解明のみならず,新しい人工触媒の開発にもつながるものと期待される.特にメタンの酸化触媒の開発は,石油に変わる次世代の化学原料としての天然ガスの有効利用といった観点から今後ますます重要度を増すはずである.
引用文献References
1) 伊東 忍,青野重利,林 高史編 (2016) フロンティア・生物無機化学,三共出版.
2) Itoh, S. (2011) in Copper-Oxygen Chemistry (Karlin, K.D. & Itoh, S. eds.), pp. 225–282, John Wiley & Sons, Inc., Hoboken, NJ, USA.
3) Mirica, L.M., Ottenwaelder, X., & Stack, T.D.P. (2004) Structure and spectroscopy of copper-dioxygen complexes. Chem. Rev., 104, 1013–1045.
4) Lewis, E.A. & Tolman, W.B. (2004) Reactivity of dioxygen-copper systems. Chem. Rev., 104, 1047–1076.
5) Solomon, E.I., Heppner, D.E., Johnston, E.M., Ginsbach, J.W., Cirera, J., Qayyum, M., Kieber-Emmons, M.T., Kjaergaard, C.H., Hadt, R.G., & Tian, L. (2014) Copper active sites in biology. Chem. Rev., 114, 3659–3853.
6) Prigge, S.T., Kolhekar, A.S., Eipper, B.A., Mains, R.E., & Amzel, L.M. (1997) Amidation of bioactive peptides: the structure of peptidylglycine alpha-hydroxylating monooxygenase. Science, 278, 1300–1305.
7) Vendelboe, T.V., Harris, P., Zhao, Y., Walter, T.S., Harlos, K., El Omari, K., & Christensen, H.E.M. (2016) The crystal structure of human dopamine β-hydroxylase at 2.9 Å resolution. Sci. Adv., 2, e1500980.
8) Klinman, J.P. (2006) The copper-enzyme family of dopamine beta-monooxygenase and peptidylglycine alpha-hydroxylating monooxygenase: resolving the chemical pathway for substrate hydroxylation. J. Biol. Chem., 281, 3013–3016.
9) Prigge, S.T., Eipper, B.A., Mains, R.E., & Amzel, L.M. (2004) Dioxygen binds end-on to mononuclear copper in a precatalytic enzyme complex. Science, 304, 864–867.
10) Elwell, C.E., Gagnon, N.L., Neisen, B.D., Dhar, D., Spaeth, A.D., Yee, G.M., & Tolman, W.B. (2017) Copper-Oxygen Complexes Revisited: Structures, Spectroscopy, and Reactivity. Chem. Rev., 117, 2059–2107.
11) Kunishita, A., Kubo, M., Sugimoto, H., Ogura, T., Sato, K., Takui, T., & Itoh, S. (2009) Mononuclear copper(II)-superoxo complexes that mimic the structure and reactivity of the active centers of PHM and DbetaM. J. Am. Chem. Soc., 131, 2788–2789.
12) Kunishita, A., Ertem, M.Z., Okubo, Y., Tano, T., Sugimoto, H., Ohkubo, K., Fujieda, N., Fukuzumi, S., Cramer, C.J., & Itoh, S. (2012) Active site models for the Cu(A) site of peptidylglycine α-hydroxylating monooxygenase and dopamine β-monooxygenase. Inorg. Chem., 51, 9465–9480.
13) Li, X., Beeson, W.T. IV, Phillips, C.M., Marletta, M.A., & Cate, J.H.D. (2012) Structural basis for substrate targeting and catalysis by fungal polysaccharide monooxygenases. Structure, 20, 1051–1061.
14) Kim, S., Ståhlberg, J., Sandgren, M., Paton, R.S., & Beckham, G.T. (2014) Quantum mechanical calculations suggest that lytic polysaccharide monooxygenases use a copper-oxyl, oxygen-rebound mechanism. Proc. Natl. Acad. Sci. USA, 111, 149–154.
15) Itoh, S., Kumei, H., Taki, M., Nagatomo, S., Kitagawa, T., & Fukuzumi, S. (2001) Oxygenation of phenols to catechols by a (mu-eta 2:eta 2-peroxo)dicopper(II) complex: mechanistic insight into the phenolase activity of tyrosinase. J. Am. Chem. Soc., 123, 6708–6709.
16) Itoh, S. & Fukuzumi, S. (2007) Monooxygenase activity of type 3 copper proteins. Acc. Chem. Res., 40, 592–600.
17) Yamazaki, S. & Itoh, S. (2003) Kinetic evaluation of phenolase activity of tyrosinase using simplified catalytic reaction system. J. Am. Chem. Soc., 125, 13034–13035.
18) Fujieda, N., Yabuta, S., Ikeda, T., Oyama, T., Muraki, N., Kurisu, G., & Itoh, S. (2013) Crystal structures of copper-depleted and copper-bound fungal pro-tyrosinase: insights into endogenous cysteine-dependent copper incorporation. J. Biol. Chem., 288, 22128–22140.
19) Fujieda, N., Murata, M., Yabuta, S., Ikeda, T., Shimokawa, C., Nakamura, Y., Hata, Y., & Itoh, S. (2013) J. Biol. Inorg. Chem., 18, 19–26.
20) Fujieda, N., Ikeda, T., Murata, M., Yanagisawa, S., Aono, S., Ohkubo, K., Nagao, S., Ogura, T., Hirota, S., Fukuzumi, S., et al. (2011) Post-translational His-Cys cross-linkage formation in tyrosinase induced by copper(II)-peroxo species. J. Am. Chem. Soc., 133, 1180–1183.
21) Cuff, M.E., Miller, K.I., van Holde, K.E., & Hendrickson, W.A. (1998) Crystal structure of a functional unit from Octopus hemocyanin. J. Mol. Biol., 278, 855–870.
22) Fujieda, N. & Itoh, S.(2015) in Encyclopedia of Inorganic and Bioinorganic Chemistry, pp.1–8, John Wiley & Sons, Ltd.
23) Baik, M.-H., Newcomb, M., Friesner, R.A., & Lippard, S.J. (2003) Mechanistic studies on the hydroxylation of methane by methane monooxygenase. Chem. Rev., 103, 2385–2420.
24) Lieberman, R.L. & Rosenzweig, A.C. (2005) Crystal structure of a membrane-bound metalloenzyme that catalyses the biological oxidation of methane. Nature, 434, 177–182.
25) Balasubramanian, R. & Rosenzweig, A.C. (2007) Structural and mechanistic insights into methane oxidation by particulate methane monooxygenase. Acc. Chem. Res., 40, 573–580.
26) Balasubramanian, R., Smith, S.M., Rawat, S., Yatsunyk, L.A., Stemmler, T.L., & Rosenzweig, A.C. (2010) Oxidation of methane by a biological dicopper centre. Nature, 465, 115–119.
27) Yoshizawa, K. (2013) Quantum Chemical Studies on Dioxygen Activation and Methane Hydroxylation by Diiron and Dicopper Species as well as Related Metal–Oxo Species Bull. Chem. Soc. Jpn., 86, 1083–1116.
28) Wang, V.C.C., Maji, S., Chen, P.P.Y., Lee, H.K., Yu, S.S.F., & Chan, S.I. (2017) Alkane Oxidation: Methane Monooxygenases, Related Enzymes, and Their Biomimetics. Chem. Rev., 117, 8574–8621.
29) Cao, L., Caldararu, O., Rosenzweig, A.C., & Ryde, U. (2018) Quantum Refinement Does Not Support Dinuclear Copper Sites in Crystal Structures of Particulate Methane Monooxygenase Angew. Chem. Int. Ed., 57, 162–166.
30) Shiota, Y., Juhász, G., & Yoshizawa, K. (2013) Role of tyrosine residue in methane activation at the dicopper site of particulate methane monooxygenase: a density functional theory study. Inorg. Chem., 52, 7907–7917.
31) Xue, X.-S., Ji, P., Zhou, B., & Cheng, J.-P. (2017) The Essential Role of Bond Energetics in C–H Activation/Functionalization. Chem. Rev., 117, 8622–8648.
著者紹介Author Profile
 伊東 忍(いとう しのぶ)
伊東 忍(いとう しのぶ)大阪大学大学院工学研究科生命先端工学専攻教授.工学博士.
略歴1958年福井県に生る.81年大阪大学工学部石油化学科卒業,83年同大学院工学研究科石油化学専攻修士課程修了,86年同大学院工学研究科応用精密化学専攻博士課程修了(工学博士),同年大阪大学工学部助手,94年助教授,99年大阪市立大学大学院理学研究科教授,2008年10月より現職.
研究テーマと抱負錯体化学,触媒化学,生物無機化学.生体触媒の分子機構解明を基盤とした触媒開発.
ウェブサイトhttp://www-bfc.mls.eng.osaka-u.ac.jp/ItohLab/
趣味スポーツ観戦,ゴルフ.
 藤枝 伸宇(ふじえだ のぶたか)
藤枝 伸宇(ふじえだ のぶたか)大阪府立大学大学院生命環境科学研究科応用生命科学専攻准教授.博士(農学).
略歴1978年兵庫県に生る.2001年京都大学農学部生物機能科学科卒業,03年同大学院農学研究科応用生命科学専攻博士前期課程修了,06年同博士後期課程修了[博士(農学)],同年日本学術振興会特別研究員(PD),京都大学次世代開拓研究ユニット・特定助教,09年大阪大学大学院工学研究科・助教,17年より現職.
研究テーマと抱負生体関連化学,生物電気化学,合成生物学.生命分子工学を駆使し,生体機能の再現に加え,触媒を始めとする様々な新規機能の創出をめざす.
ウェブサイトhttp://www.biosci.osakafu-u.ac.jp/BPC/
趣味ソルトルアーゲーム,ヤモリ飼育.