カドミウム(Cd)はかつて富山県神通川流域で起こった公害病のイタイイタイ病の原因物質であり,腎臓に蓄積し,近位尿細管障害を引き起こすことが知られている.鉱山国日本において,米の中のCd濃度は比較的高い値が今も続いている.米を主食とし,魚を多食する日本人にとってCdの健康影響は今なお重要な問題である.
Cdの生体影響,体内動態について数多くの研究が行われてきたが,Cdがどのようにして細胞に取り込まれ,また排泄されるのか,という基本的なことに関しても未解明の部分が多く残されている.Cdのみならず,多くの重金属の毒性と体内動態に影響を及ぼす生体内因子として,メタロチオネイン(MT)が知られている.MTは,Cdによって誘導され,Cdに結合し,Cdの毒性を軽減する.これまで数多くのCd耐性細胞が樹立されてきたが,そのほとんどにおいてMT遺伝子の増幅,高発現が観察されていた.このように,MTはCd毒性の修飾因子としてきわめて重要である.しかし,MTは細胞内のCdイオンをトラップしてしまうため,MTが誘導された細胞において,Cdの取り込み,排泄などを調べることは困難である.多くの薬物輸送体は,その薬物に対する耐性細胞から発見されるが,Cd耐性細胞は,そのほとんどがMT高発現細胞であるため,Cd輸送に関わる因子が変化しているか調べられていなかった.
そこで,著者らは,MT以外のCd輸送に関わる因子およびCd耐性因子を検索するため,MTノックアウトマウス由来の細胞を用いてCd耐性細胞を樹立し,その性状を解析してきた1, 2).培地中のCd濃度を段階的に上げていき,生き残った細胞だけを培養し続けるという方法で樹立したCdr-A7, Cdr-B5という二つのMT欠損Cd耐性細胞株は,いずれもCdの蓄積が親株細胞の約10%程度であった.これらの細胞株は,Cdが蓄積しにくいためにCd耐性を示すという点で,初めて樹立されたCd耐性細胞株であった.この細胞におけるCdの取り込み,排泄を解析した結果,Cdの取り込みが著しく抑制されていた.また,他の元素の取り込みも調べた結果,マンガン(Mn)の取り込みも低下していた3).
そこで,Cd蓄積の差をもたらす原因遺伝子を探索するため,Cd耐性細胞と親株細胞との遺伝子発現の差をDNAマイクロアレイにより網羅的に解析した.その結果,亜鉛(Zn)輸送体のSlc39a8(ZIP8),およびSlc39a14(ZIP14)がCd耐性細胞において著しく発現低下していることを見いだした1).ZIP8の発現を親株細胞で抑制したところ,Cdの取り込み効率が顕著に減少したことから,ZIP8がCdの細胞内取り込みに関与することが明らかになった4).また,ZIP8の発現低下の原因として,Slc39a8遺伝子のメチル化の亢進が関与していることも見いだしている5).このように,Zn輸送体の一部が,哺乳動物におけるCdの輸送に大きな役割を果たしている可能性を発見した.
著者らが,ZIP8がCdの輸送に関与することを見いだしたころ,アメリカのNebertらのグループは,Cdの投与により精巣出血を起こすマウス(D2, 129/svJ)と起こさないマウス(B6, A/J)の系統間SNP解析により,原因遺伝子がSlc39a8(ZIP8)であることを見いだした6).彼らはアフリカツメガエル卵母細胞にZIP8を高発現させるとCdの取り込みが増加することを示した7, 8).このように,著者らとアメリカのグループは,まったく異なるアプローチでほぼ同時にZIP8がCdの取り込みに関与することを見いだした.またZIP14もZIP8と同様,Cdを輸送することが明らかになった9).このようにZIP8とZIP14は必須金属であるZnの輸送体でありながら,有害金属のCdの輸送に関与することが発見され注目されるようになった.
ZIP8はさまざまな組織に広く発現しているが,精巣,腎臓,肺に高い発現がみられる12–14).タバコの煙に含まれるCdの取り込み経路として,肺上皮に発現しているZIP8が関与することが報告されている15, 16).2012年にZIP8の発現を著しく低下させたノックアウトマウスが作製されたが,器官形成や赤血球・造血系に障害を起こし,重度の貧血によって胎生致死となることが示された17).
著者らが樹立したMT欠損Cd耐性細胞は,ZIP8の発現の低下によりCdだけでなく,Mnの取り込みも低下していた3).多くの細胞において,CdとMnの取り込みが競合的に阻害されることが報告されている3, 18, 19).また,Nebertらはマウス線維芽細胞にマウスZIP8を発現させた結果,CdのみならずMnの取り込みが増加することを示している19).これらのことから,ZIP8はZnとCdのみならず,Mn輸送体としての役割を持っていると考えられる.
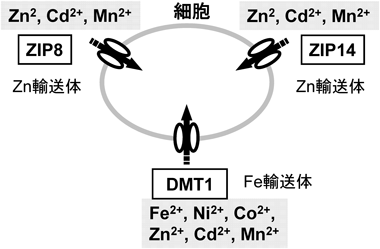
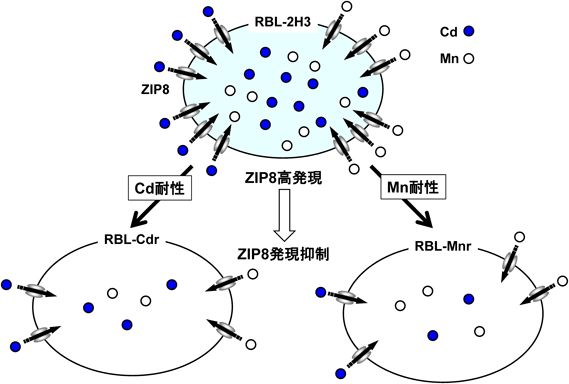
著者らは,ラット好塩基球性白血病細胞(RBL-2H3)がCdとMnをきわめて効率よく取り込み,両金属に対して高い感受性を示すこと,その原因としてZIP8の発現レベルが他の細胞株に比べて顕著に高いことを見いだした20).RBL-2H3細胞においてZIP8の発現を抑制した結果,Cdおよびmnの取り込みが抑制された.さらに,RBL-2H3細胞の培地中のCd濃度を段階的に上昇させ,生き残った細胞として樹立したCd耐性細胞(RBL-Cdr)と,同様に培地中のMn濃度を段階的に上昇させることで樹立したMn耐性細胞(RBL-Mnr)のそれぞれの性状を調べた(図2).RBL-Cdr細胞はCdのみならず,Mnに対しても交叉耐性を示し,一方,RBL-Mnr細胞はMnのみならず,Cdにも交叉耐性を示した.いずれの耐性細胞においても,CdとMn取り込み効率が親株細胞に比べて低下し,ZIP8の発現が低下していた21).CdとMnの双方に親和性を示す輸送体として,ZIP8以外にもZIP14,および二価鉄輸送体であるdivalent metal transporter 1(DMT1)がある22)(図1).しかし,DMT1およびZIP14は,RBL-CdrやRBL-MnrにおいてZIP8のような顕著な発現変化は示さなかった.以上の結果より,CdとMnの輸送において,特にZIP8の役割が重要であることが示唆された.
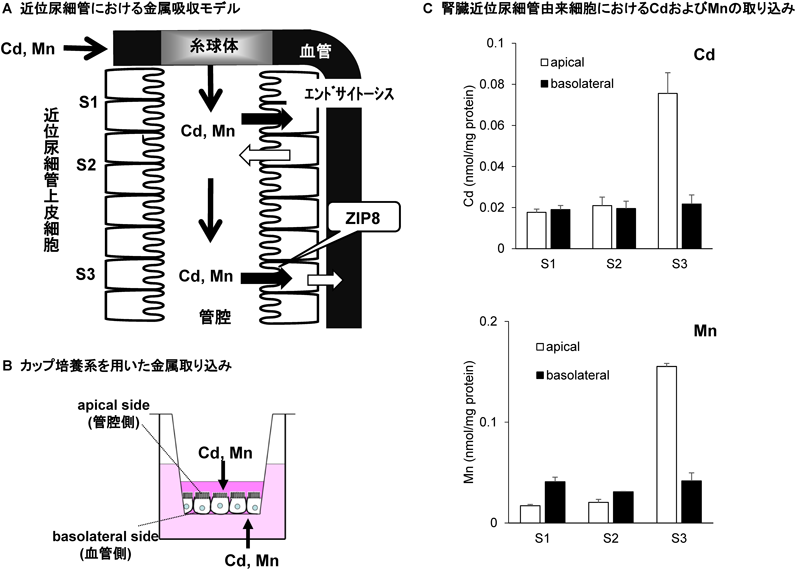
Cdは近位尿細管障害を引き起こすため,腎臓におけるCd動態におけるZIP8の役割が注目される.そこで,近位尿細管のどこにZIP8が発現しているかをマウスの腎臓のin situハイブリダイゼーションにより調べた.近位尿細管は糸球体直下からS1, S2, S3という三つの領域に分かれており,各領域で物質輸送や性質が異なる(図3A).ZIP8は皮質と髄質の境界領域で発現が高いことを見いだした22).この領域には,近位尿細管のうち特にS3領域(ヘンレ係蹄の手前の直行部)が多く存在している.そこで,近位尿細管のS3領域においてZIP8がどのような機能を果たしているのか,腎臓でのCd輸送機構におけるZIP8の役割について解析を行った.著者らは,マウスの腎臓近位尿細管由来の不死化細胞であるS1, S2, S3細胞を用いて,各領域における金属輸送能や金属感受性を解析している.さらに,trans-wellを用いたカップ培養法により,生体と同じように尿細管の管腔側と血管側のそれぞれの方向からの金属の取り込みおよび排泄を測定可能な系を樹立した(図3B).カップ培養法で解析した結果,S1, S2細胞に比べて,S3細胞における管腔側からのCdの取り込み効率が高いことを明らかにした(図3C).一方,Mnについても,S1, S2細胞に比べて,S3細胞における管腔側からのMnの取り込み効率が高いことがわかった.さらにS3細胞の管腔側からのCdの取り込みをMnが,Mnの取り込みをCdが阻害した.細胞レベルにおいてもZIP8の発現はS3細胞において最も高いことを確認している.これらの結果は,S3細胞において高発現しているZIP8がCdとMnの管腔側からの再吸収に関与していることを示唆する.
これまでのCd研究において,近位尿細管へのCdの蓄積機構として,MTと結合したCd-MTの形態でエンドサイトーシスを受ける経路しか考えられてこなかった.本研究により,Cdはエンドサイトーシスによる低分子量タンパク質の再吸収が活発に行われるS1, S2領域だけでなく,ZIP8が発現しているS3領域においても,Cdイオンの形態で取り込まれる可能性が示唆された.また近位尿細管由来の細胞を用いて,一度尿細管上皮細胞に取り込まれたCdは少ないながら再び管腔側へと排泄されることを見いだした.現在,著者らは,尿細管におけるCdの輸送について図3Aのようなモデルを提唱している.CdはS1, S2部位にエンドサイトーシスにより再吸収されたままとどまるだけでなく,一部は尿細管管腔に再排出され,S3領域において再びZIP8により再吸収されるという動的な輸送モデルである23).実は尿酸については,このような動的な輸送が以前から確認されているが,金属についてはこのような動的な輸送はまったく考慮されていなかった.
一方,Mnについても,近位尿細管由来の培養細胞を用いて,ZIP8がMnの取り込みに関与していることを見いだした.このことは,in vivoにおいてもS3領域のZIP8がMnの再吸収に関与し,必須元素であるMnの生体濃度の恒常性維持に一定の役割を果たしている可能性を予想させる.しかし,今後さらなる解析が必要である.
ZIP8がMnの輸送に寄与することは培養細胞系で明らかにされてきた.しかし,ヒトにおいてZIP8がMn輸送に本当に関与するのかはよくわかっていなかった.しかし,近年,ヒトのSLC39A8(ZIP8)の変異がMn代謝異常に関与することが報告され,Mn輸送体としてのZIP8の役割が注目されている.
ドイツのParkらは,頭蓋非対称や痙攣,小人症を発症している子供の全エキソンシークエンス解析を行った結果,SLC39A8(ZIP8)の2か所の変異が疾患の原因であることをつきとめた.この症状を示す患者がドイツで2例見つかり,それぞれZIP8のVal33MetとSer335Thr,あるいはGly38ArgとIle340Asnの2か所変異がみられた24)(表1A).またエジプトではGly38ArgのみのZIP8単一変異を持ち,同様の症状を示す患者が報告された25).これらの患者は血中Mn量が検出できないほど低下しており,先天性グリコシル化障害と同じ症状を示していた.Mn欠乏により糖鎖付加に重要なMn依存性酵素であるガラクトシルトランスフェラーゼの活性が低下し,成長遅延,斜視,小脳萎縮,などの全身症状を呈したものと考えられている.
表1 ZIP8遺伝子多型と関連が報告されている症状・金属レベル| A. 臨床データ |
|---|
| 患者情報 | 症状 | 変異 | 文献 |
|---|
| ドイツ小児 | 血中Mn量低下,頭蓋非対称,痙攣,小人症 | c.112G>C (p.Gly38Arg) | Park JH. et al., Am J Hum Genet., 2015 |
| c.1019T>A (p.Ile340Asn) |
| ドイツ小児 | 精神運動障害,小脳萎縮,斜視,脊柱側彎症 | c.97G>A (p.Val33Met) | Park JH. et al., Am J Hum Genet., 2015 |
| c.1004G>A (p.Ser335Thr) |
| エジプト小児 | 小脳萎縮,知能障害,発達遅延,低血圧,斜視 | c.112G>C (p.Gly38Arg) | Boycott KM. et al., Am J Hum Genet., 2015 |
| レバノン兄弟 | Leigh症候群,発達障害,ジストニア,血中・尿中Mn量低下 | c.339G>C (p.Cys113Ser) | Riley LG. et al., J Inherit Metab Dis., 2017 |
| B. GWAS |
|---|
| 疾患/症状 | rs番号 | 変異 | 文献 |
|---|
| 高血圧 | rs13107325 | c.1171G>T (p.Ala391Thr) | Ehret GB. et al., Nature, 2011
Tragante V. et al., Am J Hum Genet., 2014 |
| 肥満・BMI | rs13107325 | c.1171G>T (p.Ala391Thr) | Speliotes EK. et al., Nat Genet., 2010
Berndt SI. et al., Nat Genet., 2013 |
| HDLコレステロール | rs13107325 | c.1171G>T (p.Ala391Thr) | Teslovich TM. et al., Nature, 2010
Willer CJ., et al., Nat Genet., 2013 |
| 統合失調症 | rs13107325 | c.1171G>T (p.Ala391Thr) | Hertzberg L. et al., Schizophr Res 2015
Ripke BM. et al., Nature, 2014 |
| 急性冠症候群(不安定狭心症,急性心筋梗塞) | rs13107325 | c.1171G>T (p.Ala391Thr) | Johansson A. et al.,Hum Mol Genet., 2016 |
| 血中Mnレベル | rs13107325 | c.1171G>T (p.Ala391Thr) | Ng E. et al., Hum Mol Genet., 2015 |
| 血中Znレベル | rs233804 | c.840+12558G>T | Fujiwara J. et al., Leg Med (Tokyo)., 2018 |
| c.639+12558G>T |
| 尿中/赤血球中Cdレベル | rs10014145/rs233804 | c.841-11341T>C | Rentschler G. et al., Metallomics, 2014 |
| c.640-11341T>C |
また,レバノンで見つかった知的障害や小脳萎縮を有する先天性グリコシル化異常症II型(CDG)の患者においてもSLC39A8(ZIP8)の変異が見つかった26).この患者はドイツやエジプトの患者とは異なる場所に変異があり(表1),Leigh症候群というミトコンドリア病の特徴を示し,Mn酵素であるMnスーパーオキシドジスムターゼ(Mn-SOD)の活性低下が原因ではないかと議論されている.しかし,Mn-SOD活性が変化しているかどうかはまだ不明である.このようにZIP8変異によるさまざまな疾患発症のメカニズムの詳細は今後さらなる検討が必要である.これらの発見により,Mnに親和性を持つ輸送体として,他にDMT1やZIP14があるにもかかわらず,ZIP8に変異があると非常に重篤なMn代謝異常症が起こることが見つかり,Mn輸送体としてのZIP8の重要性が証明された.
では,ZIP8はどこでどのようにして全身のMn恒常性を調節しているのだろうか.体内のMn量は吸収と排泄の二つの経路によって調節されている.消化管からのMn吸収率は約2%と低いものの,Mn輸送能を持つ二価鉄輸送体のDMT1が消化管で高く発現しているため,消化管からのMn吸収にZIP8の変異が影響するとは考えにくい22, 27).一方,排泄経路には,二つの経路が考えられる.一つは胆汁からのMn排泄機構である.以前より肝臓のMnは胆汁中に多く排泄されることが知られている.ごく最近,肝臓特異的ZIP8ノックアウトマウスが作成され,胆管細胞に発現しているZIP8が消失すると,肝臓から胆汁に排泄されたMnが再取り込みされなくなり,胆汁中に排泄されるMn量が増加することが報告された.つまり,肝臓の胆管側膜(canalicular membrane)に発現するZIP8が胆汁排泄されたMnを一部回収するシステムに寄与し,全身のMn恒常性維持に重要な役割を果たしている可能性が示唆された28).
もう一つは腎臓からの尿中排泄である.著者らは近位尿細管由来の細胞を用いた検討で,S3領域にZIP8の発現が高いこと,細胞レベルでZIP8を発現抑制すると,Mnの取り込み効率が低下することを示した23).糸球体濾過を受けたMnは,原尿中から近位尿細管上皮細胞に再吸収されると考えられるが,その経路にZIP8が関与している可能性がある.このように,ZIP8の変異によって全身でMn欠乏が起こる原因として,Mnの消化管からの経路ではなく,胆管や尿細管に排泄されたMnの再吸収経路が重要である可能性が示唆されている.
しかし,肝臓や腎臓にはZIP8の他にもMn輸送体が存在する.ZIP8が機能しないだけで,なぜMnが欠乏してしまうのだろうか.Mnの取り込みには,DMT1も関与する.しかし,DMT1は肝臓におけるMnの輸送にはあまり重要ではないことが報告されている29).一方,ZIP14もMnに親和性を示し,肝臓に発現していることがわかっている.しかし,ZIP14は肝臓の胆管側膜(管腔側)ではなく,血管側に発現していること,またSLC39A14(ZIP14)に変異のある患者では,ZIP8変異患者とは逆に血中Mn量の増加がみられることから30),胆汁からのMn回収には寄与していないと考えられる.肝細胞の胆管側膜に局在するのがZIP8だけであれば,体内Mn量の調節にZIP8が重要な役割を果たすのかもしれない.
一方,臨床でのデータから,腎臓のZIP8の役割も注目され始めている.ZIP8変異によるMn代謝異常の患者の治療法として,以前はガラクトース大量投与が行われてきたが,最近,ドイツの小児科医らにより高用量のMnの投与がこれらの患者の臨床症状の改善に有効であることが示された31).SLC39A8に変異を持つ患者2名に高用量のMn投与が行われた結果,かなりの臨床的改善が観察された.その際,これらの患者にMnを投与すると尿中へのMn排泄が通常よりも増加していたことが報告されている.このことは,腎臓の近位尿細管におけるMnの再吸収にZIP8が寄与しているためと考えられる.腎臓にもDMT1が発現しているが,細胞質膜よりも,主にエンドソームに発現し,トランスフェリン(Tf)−Tf受容体を介してエンドソームに取り込まれた鉄の細胞内小器官輸送に関与していると考えられている32).今後,腎臓でのMn再吸収におけるZIP8の役割について解明が期待される.
近年,ゲノムワイド関連解析(GWAS)プロジェクトにより,低Mn血症との関係だけでなく,さまざまな疾患や症状とZIP8の一塩基多型(SNP)の関連が報告されている(表1B).統合失調症33–35),高血圧36, 37),肥満38, 39),HDLコレステロールレベル40–42),急性冠症候群(ACS)43)などのさまざまな疾患と関連を示す遺伝子領域にSLC39A8(ZIP8)が含まれていた.興味深いことに,これらの疾患や症状と関連するSLC39A8遺伝子のSNPは同一(rs13107325)でミスセンス変異であった.また血中の各金属レベルに関するデータとして,やはりZIP8の同じSNPが血中Mnレベルの低下に関与していることが報告されている.一方,SLC39A8(ZIP8)のイントロンにおけるSNPと尿中および赤血球中Cdレベルとの関連を示す報告もある.
これらの疾患にMn代謝異常は関与しているだろうか.血圧調節に関しては,Mn依存性酵素のアルギナーゼ活性が関与している可能性がある.また,HDLコレステロールなどの脂質異常については,Mn依存性酵素ガラクトシルトランスフェラーゼの機能低下により,多数のタンパク質グリコシル化と機能に影響を与えるためである可能性が示唆されている.しかし,SLC39A8(ZIP8)の変異によるこれらの病態発症との関係については,今後さらなるデータ蓄積と詳細な解析が必要だろう.
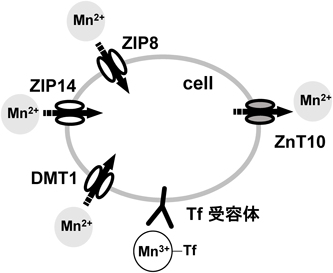
Mn輸送経路に関するこれまでの知見を図4にまとめた.Mn取り込みについては,二価Mn(Mn2+)は,DMT1, ZIP8, ZIP14を介して輸送される.三価Mn(Mn3+)はTfと結合し,Tf受容体(TfR)を介して取り込まれる.一方,Mnの排泄については,Znの排泄輸送体の一つであるZnT10が関与することが報告されている44).SLC30A10(ZnT10)に変異を持つ患者では,高Mn血症を示し,パーキンソン病様症状を引き起こすことが報告されていることからも,ZnT10は生体内Mn調節には必須であると考えられる45).このようにMnを輸送するルートは複数存在する.そのうちの一つにすぎないと考えられていたZIP8の変異により,生体内でのMn恒常性が保てなくなり重度の疾患を引き起こすことは驚きである.今後,ZIP8およびZnT10の機能不全によるさまざまな疾患発症のメカニズムの解明により,ZIP8およびZnT10の新たな生理機能やMn恒常性の調節機構の全貌が明らかになることが期待される.
引用文献References
1) Fujishiro, H., Okugaki, S., Nagao, S., Satoh, M., & Himeno, S. (2006) Characterization of gene expression profiles of metallothionein null cadmium-resistant cells. J. Health Sci., 52, 292–299.
2) Yanagiya, T., Imura, N., Kondo, Y., & Himeno, S. (1999) Reduced uptake and enhanced release of cadmium in cadmium-resistant metallothionein null fibroblasts. Life Sci., 65, PL177–PL182.
3) Yanagiya, T., Imura, N., Enomoto, S., Kondo, Y., & Himeno, S. (2000) Suppression of a high-affinity transport system for manganese in cadmium-resistant metallothionein-null cells. J. Pharmacol. Exp. Ther., 292, 1080–1086.
4) Fujishiro, H., Okugaki, S., Kubota, K., Fujiyama, T., Miyataka, H., & Himeno, S. (2009) The role of ZIP8 down-regulation in cadmium-resistant metallothionein-null cells. J. Appl. Toxicol., 29, 367–373.
5) Fujishiro, H., Okugaki, S., Yasumitsu, S., Enomoto, S., & Himeno, S. (2009) Involvement of DNA hypermethylation in down-regulation of the zinc transporter ZIP8 in cadmium-resistant metallothionein-null cells. Toxicol. Appl. Pharmacol., 241, 195–201.
6) Dalton, T.P., He, L., Wang, B., Miller, M.L., Jin, L., Stringer, K.F., Chang, X., Baxter, C.S., & Nebert, D.W. (2005) Identification of mouse SLC39A8 as the transporter responsible for cadmium-induced toxicity in the testis. Proc. Natl. Acad. Sci. USA, 102, 3401–3406.
7) He, L., Girijashanker, K., Dalton, T.P., Reed, J., Li, H., Soleimani, M., & Nebert, D.W. (2006) ZIP8, member of the solute-carrier-39 (SLC39) metal-transporter family:characterization of transporter properties. Mol. Pharmacol., 70, 171–180.
8) Liu, Z., Li, H., Soleimani, M., Girijashanker, K., Reed, J.M., He, L., Dalton, T.P., & Nebert, D.W. (2008) Cd2+ versus Zn2+ uptake by the ZIP8 HCO3--dependent symporter:kinetics, electrogenicity and trafficking. Biochem. Biophys. Res. Commun., 365, 814–820.
9) Girijashanker, K., He, L., Soleimani, M., Reed, J.M., Li, H., Liu, Z., Wang, B., Dalton, T.P., & Nebert, D.W. (2008) Slc39a14 gene encodes ZIP14, a metal/bicarbonate symporter:similarities to the ZIP8 transporter. Mol. Pharmacol., 73, 1413–1423.
10) Aydemir, T.B., Liuzzi, J.P., McClellan, S., & Cousins, R.J. (2009) Zinc transporter ZIP8 (SLC39A8) and zinc influence IFN-gamma expression in activated human T cells. J. Leukoc. Biol., 86, 337–348.
11) Kambe, T., Hashimoto, A., & Fujimoto, S. (2014) Current understanding of ZIP and ZnT zinc transporters in human health and diseases. Cellular and molecular life sciences Cell. Mol. Life Sci., 71, 3281–3295.
12) Begum, N.A., Kobayashi, M., Moriwaki, Y., Matsumoto, M., Toyoshima, K., & Seya, T. (2002) Mycobacterium bovis BCG cell wall and lipopolysaccharide induce a novel gene, BIGM103, encoding a 7-TM protein:identification of a new protein family having Zn-transporter and Zn-metalloprotease signatures. Genomics, 80, 630–645.
13) Wang, C.Y., Jenkitkasemwong, S., Duarte, S., Sparkman, B.K., Shawki, A., Mackenzie, B., & Knutson, M.D. (2012) ZIP8 is an iron and zinc transporter whose cell-surface expression is up-regulated by cellular iron loading. J. Biol. Chem., 287, 34032–34043.
14) Yang, J., Zhang, Y., Cui, X., Yao, W., Yu, X., Cen, P., Hodges, S.E., Fisher, W.E., Brunicardi, F.C., Chen, C., et al. (2013) Gene profile identifies zinc transporters differentially expressed in normal human organs and human pancreatic cancer. Curr. Mol. Med., 13, 401–409.
15) Napolitano, J.R., Liu, M.J., Bao, S., Crawford, M., Nana-Sinkam, P., Cormet-Boyaka, E., & Knoell, D.L. (2012) Cadmium-mediated toxicity of lung epithelia is enhanced through NF-kappaB-mediated transcriptional activation of the human zinc transporter ZIP8. Am. J. Physiol., 302, L909–L918.
16) Besecker, B., Bao, S., Bohacova, B., Papp, A., Sadee, W., & Knoell, D.L. (2008) The human zinc transporter SLC39A8 (Zip8) is critical in zinc-mediated cytoprotection in lung epithelia. Am. J. Physiol., 294, L1127–L1136.
17) Galvez-Peralta, M., He, L., Jorge-Nebert, L.F., Wang, B., Miller, M.L., Eppert, B.L., Afton, S., & Nebert, D.W. (2012) ZIP8 zinc transporter:indispensable role for both multiple-organ organogenesis and hematopoiesis in utero. PLoS One, 7, e36055.
18) Himeno, S., Yanagiya, T., & Fujishiro, H. (2009) The role of zinc transporters in cadmium and manganese transport in mammalian cells. Biochimie, 91, 1218–1222.
19) Nebert, D.W., Galvez-Peralta, M., Hay, E.B., Li, H., Johansson, E., Yin, C., Wang, B., He, L., & Soleimani, M. (2012) ZIP14 and ZIP8 zinc/bicarbonate symporters in Xenopus oocytes:characterization of metal uptake and inhibition. Metallomics, 4, 1218–1225.
20) Fujishiro, H., Doi, M., Enomoto, S., & Himeno, S. (2011) High sensitivity of RBL-2H3 cells to cadmium and manganese:an implication of the role of ZIP8. Metallomics, 3, 710–718.
21) Fujishiro, H., Ohashi, T., Takuma, M., & Himeno, S. (2013) Suppression of ZIP8 expression is a common feature of cadmium-resistant and manganese-resistant RBL-2H3 cells. Metallomics, 5, 437–444.
22) Gunshin, H., Allerson, C.R., Polycarpou-Schwarz, M., Rofts, A., Rogers, J.T., Kishi, F., Hentze, M.W., Rouault, T.A., Andrews, N.C., & Hediger, M.A. (2001) Iron-dependent regulation of the divalent metal ion transporter. FEBS Lett., 509, 309–316.
23) Fujishiro, H., Yano, Y., Takada, Y., Tanihara, M., & Himeno, S. (2012) Roles of ZIP8, ZIP14, and DMT1 in transport of cadmium and manganese in mouse kidney proximal tubule cells. Metallomics, 4, 700–708.
24) Park, J.H., Hogrebe, M., Gruneberg, M., DuChesne, I., von der Heiden, A.L., Reunert, J., Schlingmann, K.P., Boycott, K.M., Beaulieu, C.L., Mhanni, A.A., et al. (2015) SLC39A8 Deficiency:A Disorder of Manganese Transport and Glycosylation. Am. J. Hum. Genet., 97, 894–903.
25) Boycott, K.M., Beaulieu, C.L., Kernohan, K.D., Gebril, O.H., Mhanni, A., Chudley, A.E., Redl, D., Qin, W., Hampson, S., Kury, S., et al. (2015) Autosomal-Recessive Intellectual Disability with Cerebellar Atrophy Syndrome Caused by Mutation of the Manganese and Zinc Transporter Gene SLC39A8. Am. J. Hum. Genet., 97, 886–893.
26) Riley, L.G., Cowley, M.J., Gayevskiy, V., Roscioli, T., Thorburn, D.R., Prelog, K., Bahlo, M., Sue, C.M., Balasubramaniam, S., & Christodoulou, J. (2017) A SLC39A8 variant causes manganese deficiency, and glycosylation and mitochondrial disorders. J. Inherit. Metab. Dis., 40, 261–269.
27) Shawki, A., Anthony, S.R., Nose, Y., Engevik, M.A., Niespodzany, E.J., Barrientos, T., Ohrvik, H., Worrell, R.T., Thiele, D.J., & Mackenzie, B. (2015) Intestinal DMT1 is critical for iron absorption in the mouse but is not required for the absorption of copper or manganese. Am. J. Physiol., 309, G635–G647.
28) Lin, W., Vann, D.R., Doulias, P.T., Wang, T., Landesberg, G., Li, X., Ricciotti, E., Scalia, R., He, M., Hand, N.J., et al. (2017) Hepatic metal ion transporter ZIP8 regulates manganese homeostasis and manganese-dependent enzyme activity. J. Clin. Invest., 127, 2407–2417.
29) Chua, A.C. & Morgan, E.H. (1997) Manganese metabolism is impaired in the Belgrade laboratory rat. J. Comp. Physiol. B, 167, 361–369.
30) Tuschl, K., Meyer, E., Valdivia, L.E., Zhao, N., Dadswell, C., Abdul-Sada, A., Hung, C.Y., Simpson, M.A., Chong, W.K., Jacques, T.S., et al. (2016) Mutations in SLC39A14 disrupt manganese homeostasis and cause childhood-onset parkinsonism-dystonia. Nat. Commun., 7, 11601.
31) Park, J.H., Hogrebe, M., Fobker, M., Brackmann, R., Fiedler, B., Reunert, J., Rust, S., Tsiakas, K., Santer, R., Gruneberg, M., et al. (2017) SLC39A8 deficiency:biochemical correction and major clinical improvement by manganese therapy. Genet. Med., 20, 259–268.
32) Abouhamed, M., Gburek, J., Liu, W., Torchalski, B., Wilhelm, A., Wolff, N.A., Christensen, E.I., Thevenod, F., & Smith, C.P. (2006) Divalent metal transporter 1 in the kidney proximal tubule is expressed in late endosomes/lysosomal membranes:implications for renal handling of protein-metal complexes. Am. J. Physiol., 290, F1525–F1533.
33) Carrera, N., Arrojo, M., Sanjuan, J., Ramos-Rios, R., Paz, E., Suarez-Rama, J.J., Paramo, M., Agra, S., Brenlla, J., Martinez, S., et al. (2012) Association study of nonsynonymous single nucleotide polymorphisms in schizophrenia. Biol. Psychiatry, 71, 169–177.
34) Schizophrenia Working Group of the Psychiatric Genomics Consortium. (2014) Biological insights from 108 schizophrenia-associated genetic loci. Nature, 511, 421–427.
35) Hertzberg, L., Katsel, P., Roussos, P., Haroutunian, V., & Domany, E. (2015) Integration of gene expression and GWAS results supports involvement of calcium signaling in Schizophrenia. Schizophr. Res., 164, 92–99.
36) Ehret, G.B., Munroe, P.B., Rice, K.M., Bochud, M., Johnson, A.D., Chasman, D.I., Smith, A.V., Tobin, M.D., Verwoert, G.C., Hwang, S.J., et al. (2011) Genetic variants in novel pathways influence blood pressure and cardiovascular disease risk. Nature, 478, 103–109.
37) Tragante, V., Barnes, M.R., Ganesh, S.K., Lanktree, M.B., Guo, W., Franceschini, N., Smith, E.N., Johnson, T., Holmes, M.V., Padmanabhan, S., et al. (2014) Gene-centric meta-analysis in 87,736 individuals of European ancestry identifies multiple blood-pressure-related loci. Am. J. Hum. Genet., 94, 349–360.
38) Speliotes, E.K., Willer, C.J., Berndt, S.I., Monda, K.L., Thorleifsson, G., Jackson, A.U., Lango Allen, H., Lindgren, C.M., Luan, J., Magi, R., et al. (2010) Association analyses of 249,796 individuals reveal 18 new loci associated with body mass index. Nat. Genet., 42, 937–948.
39) Berndt, S.I., Gustafsson, S., Magi, R., Ganna, A., Wheeler, E., Feitosa, M.F., Justice, A.E., Monda, K.L., Croteau-Chonka, D.C., Day, F.R., et al. (2013) Genome-wide meta-analysis identifies 11 new loci for anthropometric traits and provides insights into genetic architecture. Nat. Genet., 45, 501–512.
40) Waterworth, D.M., Ricketts, S.L., Song, K., Chen, L., Zhao, J.H., Ripatti, S., Aulchenko, Y.S., Zhang, W., Yuan, X., Lim, N., et al. (2010) Genetic variants influencing circulating lipid levels and risk of coronary artery disease. Arterioscler. Thromb. Vasc. Biol., 30, 2264–2276.
41) Teslovich, T.M., Musunuru, K., Smith, A.V., Edmondson, A.C., Stylianou, I.M., Koseki, M., Pirruccello, J.P., Ripatti, S., Chasman, D.I., Willer, C.J., et al. (2010) Biological, clinical and population relevance of 95 loci for blood lipids. Nature, 466, 707–713.
42) Willer, C.J., Schmidt, E.M., Sengupta, S., Peloso, G.M., Gustafsson, S., Kanoni, S., Ganna, A., Chen, J., Buchkovich, M.L., Mora, S., et al. (2013) Discovery and refinement of loci associated with lipid levels. Nat. Genet., 45, 1274–1283.
43) Johansson, A., Eriksson, N., Lindholm, D., Varenhorst, C., James, S., Syvanen, A.C., Axelsson, T., Siegbahn, A., Barratt, B.J., Becker, R.C., et al. (2016) Genome-wide association and Mendelian randomization study of NT-proBNP in patients with acute coronary syndrome. Hum. Mol. Genet., 25, 1447–1456.
44) Nishito, Y., Tsuji, N., Fujishiro, H., Takeda, T.A., Yamazaki, T., Teranishi, F., Okazaki, F., Matsunaga, A., Tuschl, K., Rao, R., et al. (2016) Direct Comparison of Manganese Detoxification/Efflux Proteins and Molecular Characterization of ZnT10 Protein as a Manganese Transporter. J. Biol. Chem., 291, 14773–14787.
45) Tuschl, K., Clayton, P.T., Gospe, S.M. Jr., Gulab, S., Ibrahim, S., Singhi, P., Aulakh, R., Ribeiro, R.T., Barsottini, O.G., Zaki, M.S., et al. (2012) Syndrome of hepatic cirrhosis, dystonia, polycythemia, and hypermanganesemia caused by mutations in SLC30A10, a manganese transporter in man. Am. J. Hum. Genet., 90, 457–466.