PLA2分子群は一般に,構造や性質の特徴から,cPLA2(cytosolic PLA2),iPLA2(Ca2+-independent PLA2),sPLA2(secreted PLA2)などの群に大別される.国際命名規約に基づくと,PLA2はPLA2G2A(PLA2,Group 2, A型の意)のように表記され,データベースにはPLA2G1からG16までがリストされている.しかしながら,この命名法では各酵素がどの群に属するのか判別できないうえに,sPLA2群のみが構造上の微妙な違いを元に細分化されており,この中には植物や微生物にしか存在しないsPLA2も含まれる.哺乳動物のsPLA2はPLA2G1B, G2(A, C, D, E, Fの5種),G3, G5, G10, G12(A, Bの2種)の計11種である.一方,cPLA2群に属する酵素はPLA2G4(A~Fの6種)にひとくくりにされているが,各cPLA2間の違いは各sPLA2間の違いよりも大きい.iPLA2群に属する9種類の酵素のうち,国際命名法でリストされているのはPLA2G6のみである.このため,iPLA2群もcPLA2群にならってPLA2G6A, B, C…あるいはiPLA2β, γ, δ…と呼ばれることがあるが,それぞれの対応関係がずれているばかりか(例:PLA2G6A=iPLA2β),その多くはPLA2以外の酵素反応を触媒するため,PLA2と呼ぶこと自体に問題がある.さらには,PLA2反応を触媒するにもかかわらず,PLA2の名称を与えられていない酵素も多数存在するため,PLA2としての機能が見過ごされることもある.もちろん,PLA2ファミリー全体から見ればアラキドン酸代謝は重要な機能の一つであるが,PLA2という名前がついていれば安易にアラキドン酸代謝と結びつける着想は必ずしも正しくない.本稿では各PLA2の一般名称を使用し,必要に応じて他の名称を併記する.
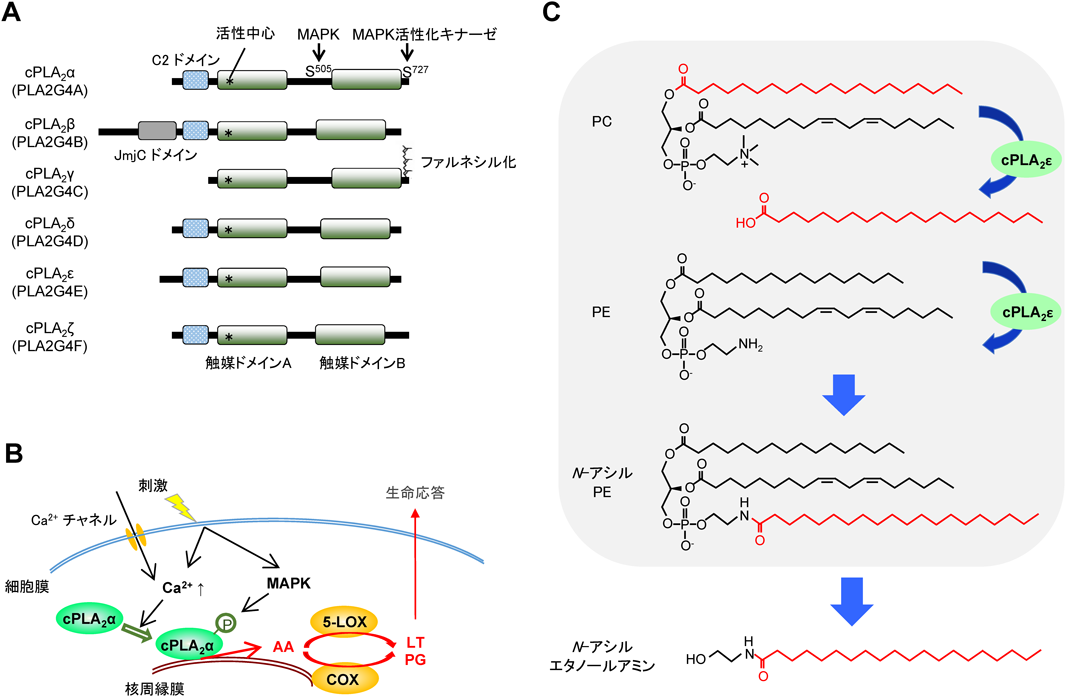
cPLA2群に属する酵素は,基本構造としてN末端領域のC2ドメインとC末端領域の触媒ドメインを持つ(図1A).酵素活性にはμM濃度のCa2+が必要であり,これは基質である細胞膜リン脂質にC2ドメインを介してCa2+依存的に結合するためである.例外的にcPLA2γはC2ドメインを持たず,細胞膜に構成的に結合し,酵素活性はCa2+非依存的である.分子進化的に,cPLA2群は後述するiPLA2群から分岐したものであり,脊椎動物に固有である.脂質メディエーター受容体の多くもまた脊椎動物にしか見いだされず,このことはcPLA2群とその代謝産物の受容体が共進化してきたことを示唆している.
1)cPLA2α/PLA2G4A
本ファミリーの代表格であるcPLA2αはアラキドン酸代謝を担う主要酵素であり,全組織に普遍的に分布する.cPLA2αならびにアラキドン酸代謝に関しては他に優れた総説が多数あるので1),ここでは概略を解説する.cPLA2αは,細胞の活性化に伴う細胞質Ca2+流入とリン酸化に応じて,ω6脂肪酸の一種であるアラキドン酸(C20:4;炭素数20,不飽和結合4の意味)をリン脂質から選択的に切り出す(図1B).正確には,cPLA2αはω3脂肪酸であるエイコサペンタエン酸(EPA;C20:5)も遊離できるが,細胞膜リン脂質中のEPAの含量は通常非常に少ないため,実質的にアラキドン酸特異的PLA2として機能する.別のω3脂肪酸であるドコサヘキサエン酸(DHA;C22:6)を持つリン脂質はcPLA2αのよい基質とはならないので,もしDHAの遊離にcPLA2αが関わることを主張している論文を見かけたら注意されたい.cPLA2αにより遊離されたアラキドン酸は,下流のシクロオキシゲナーゼ(COX)やリポキシゲナーゼ(LOX)と連関してプロスタグランジン(PG)やロイコトリエン(LT)などのエイコサノイドに変換される(図1B).cPLA2α欠損マウスの表現型はPG, LTの合成酵素や受容体の欠損マウスとおおむね合致する.ただし,cPLA2αの欠損または阻害は複数のエイコサノイドの産生を一斉に遮断するので,各エイコサノイドが拮抗的な作用を持つ場合には,互いの効果が打ち消されて表現型が顕在化しない場合もある.一方で,cPLA2αを欠損してもエイコサノイドが減少しない組織もあり,たとえば脳や肝臓のPG産生にはモノグリセリドリパーゼの寄与が大きい2).したがって,従来の定説であった「アラキドン酸代謝=cPLA2α」の図式がすべての細胞で必ずしも成り立つわけではない.
2)cPLA2β−ζ
cPLA2β, δ, ε, ζ(別名PLA2G4B, D, E, F)は同一遺伝子座にコードされ,酵素活性の測定条件によってはPLA2活性よりもPLA1活性の方が強く,またcPLA2αのような明確なアラキドン酸選択性を示さない.cPLA2δは乾癬皮膚に発現誘導される酵素として同定され,マスト細胞のエクソソームを介してランゲルハンス細胞に運ばれ,CD1a上に提示される脂質抗原を産生する役割を持つことが報告されている3).cPLA2εはリン脂質の1位の脂肪酸をホスファチジルエタノールアミン(PE)のアミノ基に転移するN-アシルトランスフェラーゼ活性を有し,エイコサノイドとは別の生理活性脂質の一群であるN-アシルエタノールアミン(NAE)の生合成に関わる可能性が提唱されている(図1C)4).cPLA2γ(PLA2G4C)はPLA2活性に加えてリゾホスホリパーゼ活性やトランスアシラーゼ活性を示し,ヒト肝細胞においてC型肝炎ウイルス感染による脂肪滴形成に関わるという5).しかしながら,cPLA2α以外の酵素の生体内機能は未解明であり,欠損マウスでの検証が待たれる.
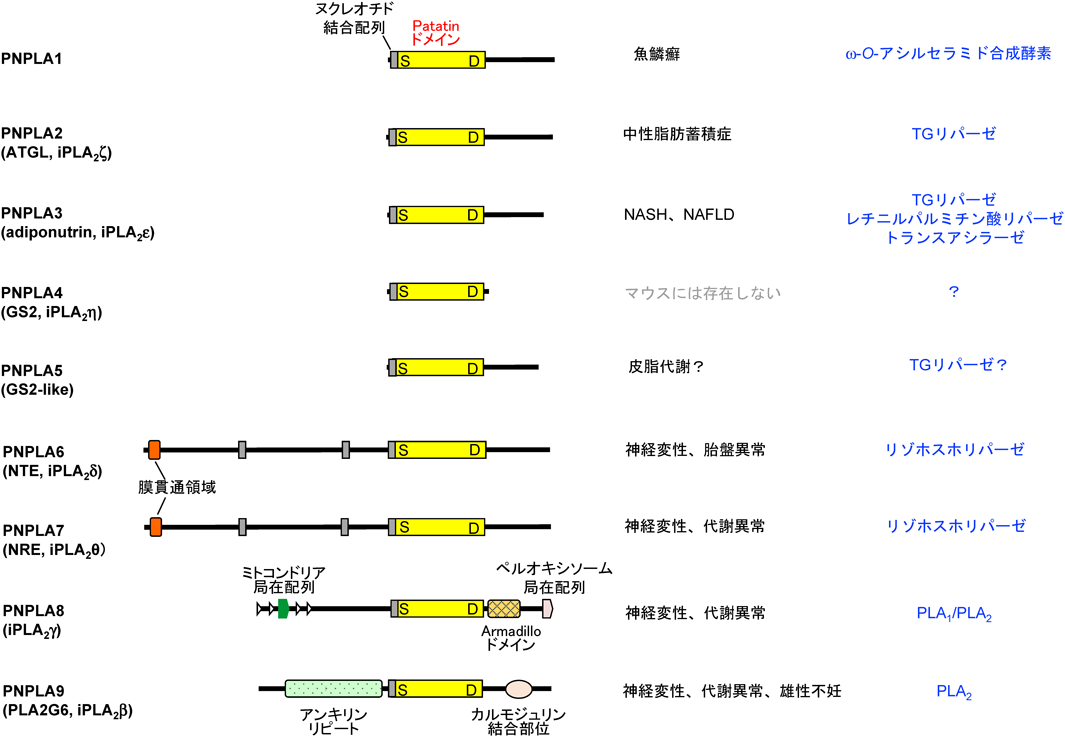
本ファミリーに属する酵素は活性にCa2+を必要とせず,植物のリパーゼであるpatatin(iPLA2α)と類似の触媒領域を持つことから,最近ではPNPLA(patatin-like phospholipase domain-containing)と呼ばれることも多い(図2).このファミリーは下等な真核生物にも広く分布することから,真核細胞の生命活動の根源となる脂質代謝を制御しているものと考えられる.実際,本ファミリーの遺伝子変異や欠損は重篤な症状を呈する場合が多い.本ファミリーが担う脂質代謝反応は多様であり,PLA2という名称を鵜呑みにすると機能を誤認することがあるので注意されたい.
1)iPLA2β/PLA2G6/PNPLA9
iPLA2ファミリーのうち,正真正銘のPLA2としてリン脂質に作用するのはiPLA2βのみである.本酵素は全身に普遍的に分布し,欠損マウスはインスリン分泌の異常,耐糖能の低下,脂肪肝の改善,神経変性,雄性不妊,アポトーシスの調節など,モデル系に応じて数多くの表現型を呈する6).ヒトiPLA2βの変異によって生じる神経変性疾患には,脳内鉄蓄積型神経変性,乳児型神経軸索ジストロフィー,パーキンソニズム・ジストニア症候群などがある7).神経疾患(特にパーキンソン病)の研究領域では,本酵素はPARK14とも呼ばれる.iPLA2βの作用機序については諸説あり,生命応答に応じて膜リン脂質のリモデリングや生理活性脂質の産生に関わることが提唱されている.たとえばiPLA2β変異による神経変性の分子機序に関する仮説として,神経細胞の膜リン脂質の脂肪酸組成の変容や,リゾリン脂質の減少によるドパミン神経のCa2+チャネルの開口異常などが提唱されている8).ごく最近,iPLA2βの結晶構造が解かれ,本酵素が触媒ドメインを通じてホモ二量体を形成すること,本ホモ二量体に対しカルモジュリン1分子が結合して酵素活性を調節すること,本酵素のN末端領域のアンキリンリピートが(おそらく何らかのタンパク質との結合を介して)細胞膜に結合すること,が報告された9).
2)iPLA2γ/PNPLA8
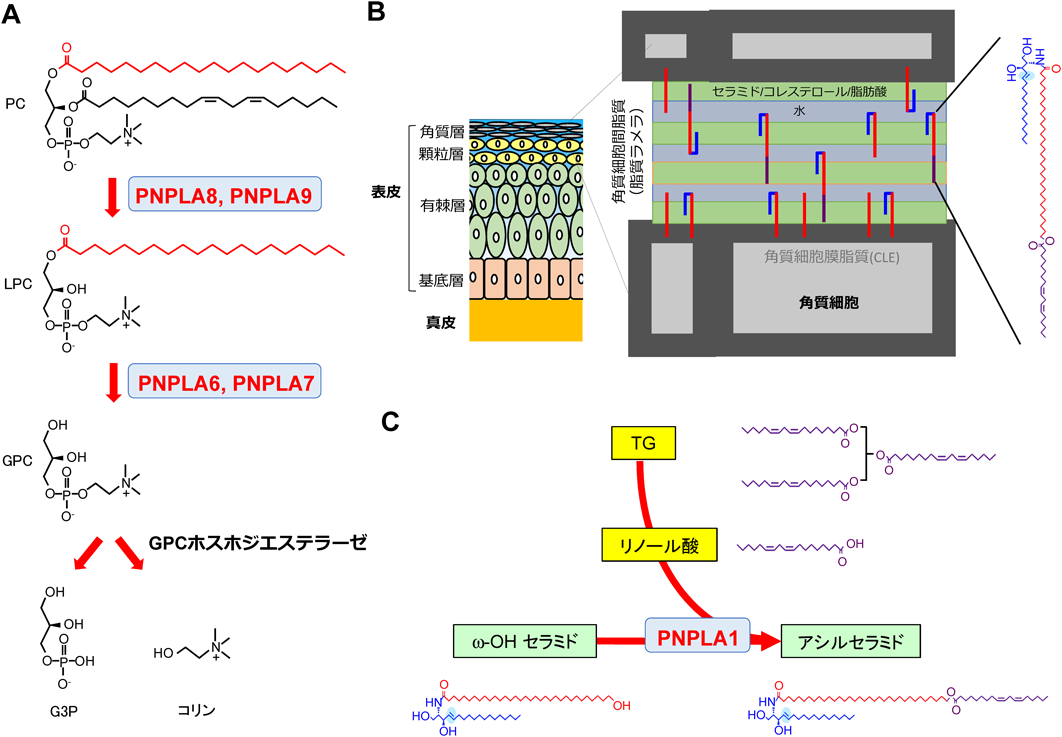
iPLA2γはミトコンドリアとペルオキシソームに局在する酵素で,本質的にはPLA2であるが,リン脂質の2位に高度不飽和脂肪酸がある場合にはPLA1活性が優位となり,高度不飽和脂肪酸をsn-2位に持つリゾリン脂質を産生する10).iPLA2γは酸化カルジオリピンの代謝に関わり,ミトコンドリアの機能維持に重要である11).このため,iPLA2γの欠損や変異は,脂質代謝異常やミトコンドリア障害に関連して,エネルギー代謝の盛んな骨格筋,心筋,脂肪組織や脳神経系を中心に,筋力減退,脂肪組織退縮,体温低下,神経変性などの表現型を生じる12).iPLA2γ欠損マウスの虚血心筋ではエイコサノイドやリゾリン脂質の産生が低下し,心筋特異的過剰発現マウスでは逆に増加する13).iPLA2γの変異が関わるヒト疾患としては,乳酸アシドーシスを伴うミトコンドリアミオパチーがある14).我々の予備知見によれば,少なくとも肝臓におけるホスファチジルコリン(PC)分解経路において,PNPLA8は後述するPNPLA7(リゾホスホリパーゼ)の上流に位置する主要PLA2の一つである(図3A).
3)PNPLA6/NTE/iPLA2δとPNPLA7/NRE/iPLA2θ
PNPLA6とPNPLA7はPLA2の代謝産物であるリゾホスファチジルコリン(LPC)から脂肪酸とグリセロホスホコリン(GPC)を遊離するリゾホスホリパーゼである(図3A)15, 16).PNPLA6は有機リン系殺虫剤の標的分子として同定された経緯からNTE(neuronal target esterase),PNPLA7はその近縁分子であることからNRE(NTE-related esterase)とも呼ばれる.PNPLA6ホモ欠損は胎盤異常による胎生致死,ヘテロ欠損は多動性障害による自発運動量の亢進を生じる17).また,PNPLA6をマウスやハエで神経特異的に欠損させると,広範囲に神経変性が起こる18).ヒトPNPLA6の変異は,痙縮,ニューロパチー,運動失調,性腺機能低下,網膜脈絡膜萎縮など幅広い症状を呈する遺伝性疾患(Boucher-Neuhäuser症候群,Laurence-Moon症候群,Oliver-McFarlane症候群,痙性対麻痺)の原因となる19, 20).PNPLA7欠損マウスは全身(特に肝臓)の代謝が乱れて早期老化様の表現型を呈し,成体になる前に死亡する(投稿準備中).PNPLA6, 7の欠損または変異による激しい表現型は,リゾホスホリパーゼ反応の産物であるGPCのさらに下流で生じるコリンやグリセロール3-リン酸(G3P)の代謝が乱れるためと予想される(図3A).また,腎臓においては高濃度のNaClによりPNPLA6が発現上昇し,浸透圧調節物質としてのGPCの産生に関与することが報告されている21).
4)ATGL/PNPLA2/iPLA2ζ
PNPLA2はATGL(adipose triacylglycerol lipase)の名称で非常に有名な酵素であり,本稿でもATGLの呼称を用いる.ATGLは脂肪分解(lipolysis)に必須のトリグリセリド(TG)リパーゼである.ATGLによりTGから遊離された脂肪酸はβ酸化に供されると同時に,核内受容体PPARαやPPARδの内因性リガンドとして作用し,エネルギー消費を高める22).ATGLにより白色脂肪から遊離された脂肪酸は褐色脂肪における熱産生に利用される23).このため,ATGL欠損マウスは低温適応障害を示すほか,全身組織にTGが過剰に沈着し,心不全のため早期に死亡する24).この病態は,ヒトでは中性脂肪蓄積ミオパチーや中性脂肪蓄積心筋血管症として知られる25).一方で,ATGL欠損マウスでは脂肪酸の供給が制限されるため,代替的に糖の利用が亢進し,耐糖能とインスリン感受性が向上する24).ATGLにより遊離される脂肪酸やグリセロールは栄養源として多くのがん細胞の増殖を促進する.がん悪液質と呼ばれる終末病態では白色脂肪の脂肪分解が異常亢進して特徴的な痩せ方を伴う衰弱状態に至るが,ATGL欠損マウスでは脂肪分解が抑えられるため悪液質が進行しにくい26).このことから,ATGL阻害薬によってがんの増殖と悪液質を抑制できる可能性がある.また細胞によっては,ATGLによりTGから遊離されたアラキドン酸がエイコサノイドの産生に供される.ATGLについては他に優れた総説があるので,合わせて参照されたい27).
5)PNPLA3/adiponutrin/iPLA2ε
PNPLA3が最近注目を集めている理由は,その遺伝子多型I148Mが非アルコール性脂肪性肝疾患(NAFLD),非アルコール性脂肪肝炎(NASH)の重大な危険因子となるからである28).実際,PNPLA3のI148M変異体を肝臓に過剰発現させたマウスは脂肪肝となる29).PNPLA3は肝細胞においてTGリパーゼとして機能すると考えられるが,脂肪分解ではなく脂肪合成(lipogenesis)に相関して発現が増加することから,リパーゼの逆反応(トランスアシラーゼ)を触媒している可能性も指摘されている.最近の研究によれば,PNPLA3は肝細胞よりも肝星細胞に高発現している.肝星細胞はビタミンAをレチニルパルミチン酸として脂質滴に貯蔵するが,肝線維化の際には脂質滴を失って筋線維芽細胞に分化する.PNPLA3は肝星細胞において脂肪滴のレチニルパルミチン酸を分解するリパーゼとしてビタミンAの供給量を調節しており,上記PNPLA3変異により酵素活性が低下することが肝疾患と結びつくという仮説が提唱されている30).
6)PNPLA1
PNPLA1は表皮上層の顆粒層に限局発現しており,難治性皮膚疾患である魚鱗癬の原因遺伝子である31).PNPLA1は皮膚バリアに不可欠な角質細胞間脂質の主要構成成分であるω-O-アシルセラミドの生合成に関わる32, 33).ω-O-アシルセラミドは,超長鎖脂肪酸(炭素数28~38)のω末端にリノール酸がエステル結合した特殊なセラミドであり,PNPLA1はω-O-アシルセラミドの前駆体であるω-OHセラミドの水酸基にTGからリノール酸を転移するトランスアシラーゼとして働く(図3B, C).PNPLA1欠損マウスではω-O-アシルセラミドが合成されないため,重篤な皮膚バリア異常に起因する体表面からの水分喪失により出生後1日以内に死亡する32).PNPLA1は,加水分解(リノール酸の遊離)ではなくアシル化(リノール酸の転移)を触媒する点,グリセロ脂質ではなくスフィンゴ脂質の代謝に関わる点,「超長鎖脂肪酸」と「リノール酸」を特異的に認識する点において,広義のPLA2の中でもとりわけ異質である.
7)PNPLA4/iPLA2η/GS2とPNPLA5/GS2-like
PNPLA2, 3との構造上の類似性からPNPLA4(マウスには存在しない)やPNPLA5も中性脂質の代謝に関わるものと予想されるが,正確な機能は明らかとなっていない.PNPLA5はオートファジーに伴う脂肪滴TGの分解に関わる可能性が指摘されているが34),全組織に普遍的に分布しているわけではなく,この仮説が一般化できるかどうかは疑問である.我々の検討によれば,PNPLA5の発現は皮脂腺に限局しており,皮脂成分の代謝に関わっている可能性が高い.
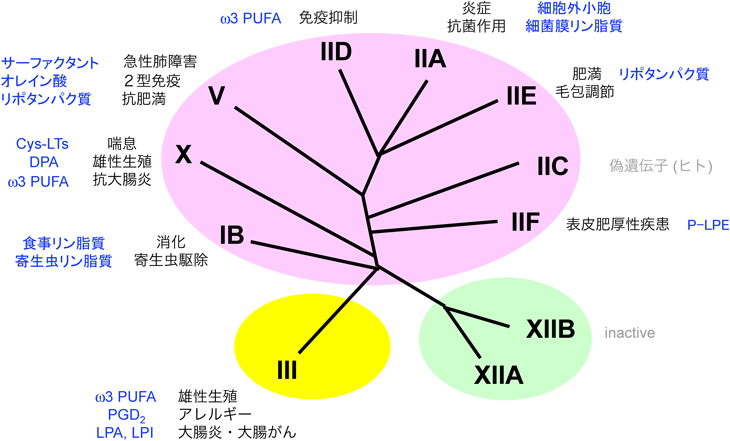
sPLA2の分類は元来,ヘビ毒(I, II型)やハチ毒(III型)に含まれるsPLA2の古典的分類に基づいており,プロペプチドやC末端延長配列の有無,分子内ジスルフィド結合の位置関係が分類の指標となる.哺乳動物には11種類のsPLA2が存在するが,このうちsPLA2-I/II/V/Xはヘビ毒sPLA2,sPLA2-IIIはハチ毒sPLA2と類似している.sPLA2-XIIは活性中心を除き,そのどちらとも相同性がない.sPLA2は細胞外に分泌され,mM濃度のCa2+の存在下で細胞外に存在するリン脂質の2位の脂肪酸を加水分解する.各sPLA2は異なる組織分布と基質選択性を示し,それゆえに組織固有の脂質代謝を動かし,特有の生命応答に関わる(図4).sPLA2群の詳細については他の総説も参照されたい35, 36).
1)sPLA2-IB/PLA2G1B
sPLA2-IBは膵腺細胞から小腸内腔に分泌される消化酵素であり,基質は食餌および胆汁に含まれるリン脂質である.多くの膵液消化酵素と同様にsPLA2-IBにもN末端にプロペプチドがあり,これが小腸内腔でトリプシンにより切断されることで活性化される.sPLA2-IB欠損マウスは小腸からのPCの分解産物(LPC)の吸収が減少し,高脂肪食負荷時において肝臓のインスリン抵抗性が改善し,また肥満や動脈硬化になりにくい37).一方,寄生虫が小腸内に感染すると,小腸上皮細胞の一部の集団にsPLA2-IBが発現誘導され,寄生虫の膜リン脂質(PE)を分解することで寄生虫駆除に関わる38).寄生虫の駆除には2型免疫が関わることが知られているが,sPLA2-IB欠損マウスは2型免疫が十分に誘導された状況下でも寄生虫を十分に排除することができない.
2)sPLA2-IIA/PLA2G2A
sPLA2-IIAはもともと,リウマチ関節炎患者の関節滲出液から精製された.この酵素の血中濃度は炎症の進行度とよく相関し,たとえば循環器病領域では動脈硬化性疾患の炎症バイオマーカーとして認識されている.sPLA2-IIAは炎症刺激により上皮細胞,免疫細胞,血管平滑筋細胞などに発現誘導される.sPLA2-IIAの第一の役割は,細菌の膜リン脂質を分解することによる感染防御である39).sPLA2-IIAはリン脂質に結合している脂肪酸の種類を識別しないが,極性基に関してはPCよりもPEに対する選択性がはるかに強く,これは細菌の膜リン脂質がPEに富むことと一部関連があるものと思われる.一方,感染を伴わない自然炎症においては,sPLA2-IIAは血小板や白血球から放出された細胞外小胞(細胞外ミトコンドリアやエクソソーム)のリン脂質を分解して脂肪酸を非特異的に遊離し,炎症性脂質メディエーターの産生を介して炎症を増悪する40).ミトコンドリアの起源は細胞内共生細菌ともいえるので,細胞外に放出されたミトコンドリアがsPLA2-IIAの優れた標的基質となることは,ある意味理にかなっている.したがって,sPLA2-IIAは抗菌酵素として感染性炎症を抑える反面,炎症性酵素として自然炎症を増悪する「諸刃の剣」的な側面を持つ.
マウスにおけるsPLA2-IIAの発現はヒトやラットなど他の動物種と大きく異なっており,フレームシフト自然変異によりまったく発現していないか(C57BL/6, A/J, C58/J, P/J, 129/Svなど),小腸パネット細胞と大腸上皮細胞にほぼ限局して発現している(BALB/c, C3H, NZB, DBAなど).前者の系統は後者の系統よりも腸管ポリープを発生しやすく,C57BL/6系統にsPLA2-IIAを強制発現すると腸管ポリープが減少することから,sPLA2-IIAには大腸がんを抑える作用があるものと考えられる41).そのメカニズムとして,sPLA2-IIAが腸幹細胞の分化やPGE2の産生に影響を与えることが提唱されているが42),この説は一般に知られるPGE2の大腸がん促進作用と相容れず,再検証が必要である.我々は最近,BALB/cマウスに抗生物質を経口投与すると小腸におけるsPLA2-IIAの発現が著減すること,sPLA2-IIAを欠損させたBALB/cマウスでは腸内フローラが劇的に変化することを発見した(未発表).この結果から我々は,sPLA2-IIAの抗細菌作用による腸内フローラの変容が二次的に大腸がんの感受性に影響を与えているものと予想している.
3)sPLA2-IIC/PLA2G2C
sPLA2-IICはヒトでは偽遺伝子である.マウスにおいてB型肝炎ウイルスを感染させると,肝臓におけるsPLA2-IICの発現が増加する.sPLA2-IICをノックダウンすると,CD1dを介したリゾリン脂質抗原のNKT細胞への提示が損なわれ,抗ウイルス免疫が低下する43).
4)sPLA2-IID/PLA2G2D
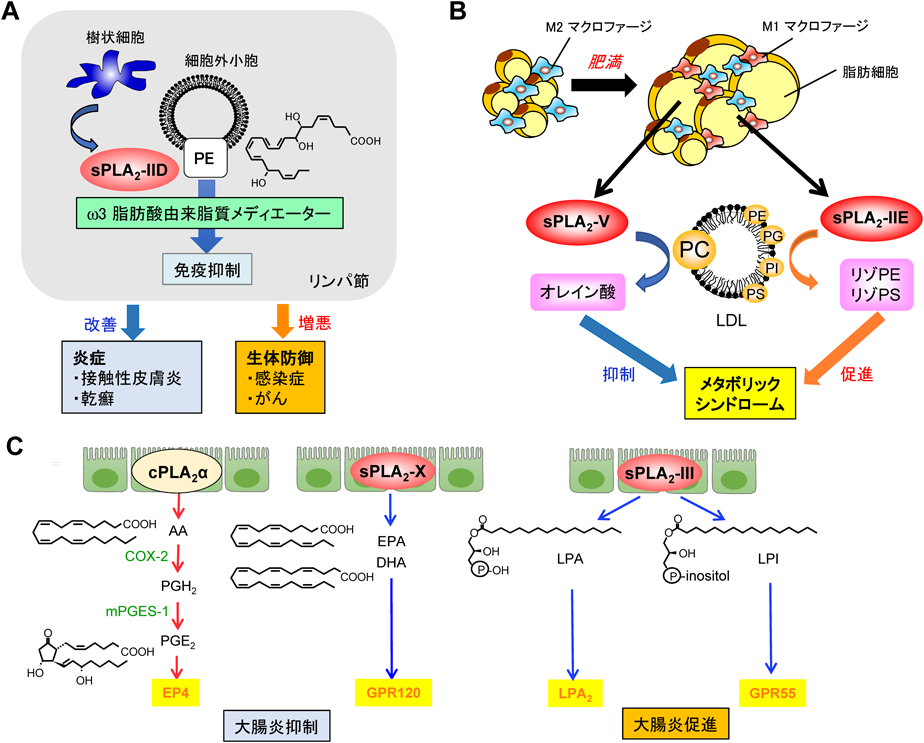
sPLA2-IIDは脾臓やリンパ節などのリンパ組織の樹状細胞に構成的に高発現しており,免疫応答を抑制する役割を担う.すなわち,sPLA2-IIDは獲得免疫が始動する場であるリンパ組織においてPEからDHAなどのω3脂肪酸に由来する抗炎症性脂質メディエーター(レゾルビンD1など)を構成的に動員し,免疫応答にブレーキをかける(図5A).sPLA2-IID欠損マウスではω3脂肪酸が減少するため免疫のブレーキが効きにくく,接触性皮膚炎におけるTh1応答や乾癬におけるTh17応答が増悪する44, 45).一方,本欠損マウスでは抗ウイルス免疫や抗腫瘍免疫が増強されるため,ウイルス性肺炎や皮膚がんが改善する46).また,sPLA2-IIDは白色脂肪組織のM2マクロファージに発現しており,ω3脂肪酸を動員して脂肪組織の慢性炎症を抑えるとともに,脂肪細胞のベージュ化を促進して熱産生を高め,肥満に対して防御的に働く(投稿準備中).ヒトにおけるsPLA2-IIDの変異は慢性閉塞性肺疾患(COPD)の重症度と相関する47).
5)sPLA2-IIE
sPLA2-IIEは肥満の脂肪細胞に発現誘導され,リポタンパク質の微量リン脂質であるPEやホスファチジルセリン(PS)を脂肪酸非特異的に分解して,リポタンパク質の脂質運搬能に影響を及ぼす(図5B)48).このため,sPLA2-IIE欠損マウスに高脂肪食を与えると肥満と高脂血症が有意に改善する.一方,高齢のsPLA2-IIE欠損マウスではむしろ脂肪細胞の脂肪分解が低下して脂肪が溜まりやすいという報告もあり49),おそらくこれと関連して,我々は本酵素が低温下で褐色脂肪細胞に発現誘導されることを見いだしている(未発表).一方,sPLA2-IIEは毛周期の増殖期に同調して毛包に発現しており,欠損マウスは体毛の微細構造が乱れる50).
6)sPLA2-IIF
sPLA2-IIFは表皮角化細胞から分泌され,主にDHAを含有しているプラズマローゲン(アルケニル型PE)からリゾプラズマローゲン(アルケニル/プラズマローゲン型リゾPE:P-LPE)を遊離して,表皮肥厚疾患の増悪に関わる51).表皮角化細胞におけるsPLA2-IIFの発現はIL-17AやIL-22などのTh17サイトカインにより誘導される.このため,sPLA2-IIF欠損マウスでは乾癬や皮膚がんなどの表皮肥厚疾患が改善する一方,過剰発現マウスは乾癬様の表皮肥厚を自然発症する.またsPLA2-IIF欠損マウスではテープ剥離後の角質バリアの回復が遅延することから52),本酵素により遊離されるDHAに角質の修復を助ける働きがあるものと推察している.
7)sPLA2-V
sPLA2-Vはリン脂質から不飽和度の低い不飽和脂肪酸(オレイン酸やリノール酸)を比較的選択的に遊離する性質を持つ.本酵素は肥満の脂肪細胞に発現誘導され,低密度リポタンパク質(LDL)のPCからオレイン酸を遊離し,飽和脂肪酸によるM1マクロファージの誘導に拮抗して慢性炎症を抑制することで,肥満に対して防御的に働く(図5B)48).したがって,sPLA2-V欠損マウスでは高脂肪食肥満に伴う脂肪組織の慢性炎症とインスリン抵抗性が増悪する.
また,sPLA2-Vは気道アレルギーの病態においてIL-4やIL-13の刺激によりM2マクロファージに発現誘導され,オレイン酸を遊離することで自然リンパ球ILC2の活性化を増強してTh2免疫を高めるとともに,気管支上皮細胞から肺胞を保護するサーファクタントPCを分解することで,喘息の増悪に関わる53–55).sPLA2-V欠損マウスの樹状細胞は抗原の取り込みが低下するため,Th2免疫応答が生じにくい56).加えて,sPLA2-V欠損マウスのマクロファージはM2形質を獲得しにくく,貪食能が低い.このため,sPLA2-Vの欠損や阻害はTh2依存的喘息を軽減する一方,病原菌や異物のクリアランスを低下させて感染性肺炎や関節炎の増悪を招く57, 58).
8)sPLA2-X
sPLA2-Xはアラキドン酸やω3脂肪酸などの高度不飽和脂肪酸(PUFA)を持つリン脂質に比較的高い選択性を示す.本酵素は気管支上皮細胞に構成的に発現しており,喘息の進行に伴い増加する.上述のsPLA2-V欠損マウスと類似して,sPLA2-X欠損マウスでも肺におけるILC2の活性化が低下し,Th2依存的な気道炎症が軽減する59, 60).しかしながら,sPLA2-Vの場合とは異なり,sPLA2-Xが肺において動員する脂質は,2型免疫の亢進に関わるエイコサノイドとして知られるシステイニルロイコトリエン(cys-LTs;LTC4, D4, E4の総称)である.すなわち,気管支上皮細胞から分泌されたsPLA2-Xはオートクリン的にアラキドン酸を直接遊離するとともに61),パラクリン的に好酸球に作用してLPCを生成し,これが間接的に好酸球のcPLA2αを活性化してLTC4の産生を促す62).
sPLA2-Xを最も高発現している組織は大腸と精巣である.sPLA2-Xは大腸上皮の主要sPLA2の一つであり,抗炎症性のω3脂肪酸を動員して大腸炎を抑制する(図5C)63).このため,sPLA2-X欠損マウスの大腸ではEPAとDHAが減少し,炎症性Th17応答が亢進して大腸炎が増悪する.また,精子の活性化によりアクロソームから放出されたsPLA2-Xは,精子の膜リン脂質からDHAとドコサペンタエン酸(DPA;C20:5)およびLPCを遊離する63, 64).sPLA2-X欠損マウスの精子は卵子との受精率が低下するが,ここにDPAやLPCを添加すると受精能が回復する.
9)sPLA2-III
sPLA2-IIIは上述のsPLA2-I/II/V/Xと構造的に異なっており,むしろハチ毒のsPLA2(III型)に近い.本酵素はリン脂質の極性基を識別しないが,脂肪酸側鎖については高度不飽和脂肪酸に選択性が高い.sPLA2-IIIは精巣上体の上皮細胞から分泌されて内腔を通過する精子膜リン脂質の脂肪酸リモデリングを調節し,精子の運動性の獲得に関わる65).また,sPLA2-IIIは未成熟なマスト細胞から分泌されて局所微小環境のPGD2を動員し,マスト細胞の成熟を促進する66).大腸上皮細胞に発現しているsPLA2-IIIは,リゾホスファチジン酸(LPA)やリゾホスファチジルイノシトール(LPI)などのリゾリン脂質を動員して大腸炎や大腸がんの増悪に関わる(図5C)67).したがって,sPLA2-III欠損マウスは雄性不妊,アレルギー不応答,大腸炎・大腸がん軽減の表現型を示す.また,sPLA2-III過剰発現マウスでは動脈硬化が増悪し68),欠損マウスでは逆に改善する(未発表).これは,血管内皮細胞のsPLA2-IIIがLDLのリン脂質を分解してLPCに富む変性LDLを生成し,マクロファージの泡沫化を促進するためと考えられる.sPLA2-IIIはゲノム上に類縁分子が存在せず,アレルギー,大腸疾患,動脈硬化の有望な創薬標的候補である.
10)sPLA2-XII
sPLA2-XIIは活性中心のモチーフ以外に他のsPLA2と共通点がなく,sPLA2群の中では最も異質である.PLA2活性を持つsPLA2-XIIAと酵素活性を持たないsPLA2-XIIBが存在する.sPLA2-XIIA欠損マウスを用いた我々の最近の解析によれば,本酵素は高度不飽和脂肪酸を持つPEとPCに基質特異性が高く,免疫応答や代謝応答の特定の局面で機能していることを見いだしつつある(未発表).
1)PAF-AHファミリー
PAF-AH(platelet-activating factor acetylhydrolase)は脂質メディエーターPAFや酸化リン脂質を加水分解するPLA2の一群である.血漿型PAF-AH(PLA2G7)は当初,PAFを消去することでアレルギー喘息の軽減に関わることが想定されていたが,ヒトにおける本酵素の先天的欠損と喘息の因果関係は証明されていない.むしろ,本酵素は別名Lp-PLA2(lipoprotein-associated PLA2)として特に動脈硬化の分野で有名であり,ヒトでの血中濃度は動脈硬化と正の相関を示すことが明らかとなっている69).これは,本酵素によりリポタンパク質から遊離されるLPCや酸化脂肪酸が動脈硬化に促進的に働くためと考えられている.また,Lp-PLA2欠損マウスでは大腸がんが軽減する70).
Lp-PLA2の細胞内ホモログであるII型PAF-AH(PAF-AH2/PLA2G7B)は細胞膜中の酸化リン脂質を分解し,酸化ストレスから細胞を保護する役割を持つ71).一方,PAF-AH2が切り出すω3脂肪酸の酸化代謝物(ω3エポキシド)は抗原依存的なマスト細胞の活性化を最適化する役割を担う.したがって,PAF-AH2欠損マウスではω3エポキシドが減少するためマスト細胞が沈静化し,それに応じてアレルギーが軽減する72).この結果は,ω3脂肪酸は常に体に優しいというわけではなく,生体にとって不都合な方向にも作用しうることを意味している.
I型PAF-AHはPLA2G8に属し,二つの活性サブユニット(Aまたはα1, Bまたはα2)と非触媒サブユニット(別名LIS1)の三量体を形成する.両触媒サブユニットを欠損すると,メカニズムは不明ながら雄性不妊を生じる73).
2)PLA2G15/LPLA2
リソソームPLA2(LPLA2)はPLA2G15に分類され,LCAT(lecithin cholesterol acyltransferase)ファミリーに属する.本ファミリーのプロトタイプであるLCATはリポタンパク質HDLのPCのsn-2位から脂肪酸を切り出し(PLA2反応),これをコレステロールに転移する(トランスアシラーゼ反応).一方,PLA2G15/LPLA2はリソソーム内の酸性条件下でPLA1/A2活性を示し,リソソームに取り込まれたリン脂質を分解する.PLA2G15の欠損マウスは肺胞マクロファージ内に未消化のサーファクタントPCが蓄積する他,リソソーム内の脂質を適切にCD1dに提示できず,微生物脂質抗原や自己脂質抗原に対する免疫応答が低下する74, 75).
3)PLA2G16ファミリー
このファミリーは別名PLAAT(phospholipase A/acyltransferase)とも呼ばれ,構造的にはLRAT(lecithin retinol acyltransferase)と近縁で,ヒトには5種,マウスには3種の酵素が存在する.PLA2G16/PLAAT3は脂肪細胞特異的に誘導されるPLA2(Ad-PLA2; adipose-specific PLA2)として最初に報告され,欠損マウスは肥満に抵抗性を示す76).この要因として,本酵素が脂肪細胞のPGE2を動員して脂肪分解を抑制すると報告されたが,その後の解析でPLA2G16はPLA2よりもPLA1としての活性が強いことが判明し,作用機序については再検証が必要である.過剰発現細胞を用いた解析によれば,PLA2G16はペルオキシソームの形成を促進し,エーテル型リン脂質の産生に関わる77).また,作用機序は不明だが,PLA2G16はがんの悪性化やピコナウイルスの感染に関わるという78).PLA2G16以外の酵素はPLA1/A2活性に加えてN-アシルトランスフェラーゼ活性を持ち,N-アシルエタノールアミンの生合成に関わるものと推察されている.
4)ABHDファミリー
ABHD(α/β hydrolase)ファミリーは20種近くの酵素を含み,分子内にリパーゼモチーフとアシルトランスフェラーゼモチーフを有する.ABHDファミリーの中にPLA2の名称を与えられている酵素は存在しないが,PLA2もしくは類縁の活性を示すものがある.たとえば,ABHD3は中鎖脂肪酸含有リン脂質,ABHD4はN-アシルリン脂質,ABHD12はリゾホスファチジルセリン(LysoPS),ABHD16AはPSにそれぞれ作用するPLA1/A2またはリゾホスホリパーゼである79–81).ABHD12のヒト変異は多発性神経障害,難聴,白内障などの症状を呈し,欠損マウスでは脳にLysoPSが蓄積する82).また,ABHD5(別名CGI-58)は酵素活性を持たないが,その変異に起因するChanarin-Dorfman症候群では中性脂肪蓄積に加えて魚鱗癬を呈する83).これは,ABHD5が前者ではPNPLA2/ATGL,後者ではPNPLA1のコファクターとして働くためと考えられる.
引用文献References
1) Shimizu, T. (2009) Lipid mediators in health and disease:enzymes and receptors as therapeutic targets for the regulation of immunity and inflammation Annu. Rev. Pharmacol. Toxicol., 49, 123–150.
2) Nomura, D.K., Morrison, B.E., Blankman, J.L., Long, J.Z., Kinsey, S.G., Marcondes, M.C., Ward, A.M., Hahn, Y.K., Lichtman, A.H., Conti, B., et al. (2011) Endocannabinoid hydrolysis generates brain prostaglandins that promote neuroinflammation Science, 334, 809–813.
3) Cheung, K.L., Jarrett, R., Subramaniam, S., Salimi, M., Gutowska-Owsiak, D., Chen, Y.L., Hardman, C., Xue, L., Cerundolo, V., & Ogg, G. (2016) Psoriatic T cells recognize neolipid antigens generated by mast cell phospholipase delivered by exosomes and presented by CD1a J. Exp. Med., 213, 2399–2412.
4) Ogura, Y., Parsons, W.H., Kamat, S.S., & Cravatt, B.F. (2016) A calcium-dependent acyltransferase that produces N-acyl phosphatidylethanolamines Nat. Chem. Biol., 12, 669–671.
5) Su, X., Liu, S., Zhang, X., Lam, S.M., Hu, X., Zhou, Y., Chen, J., Wang, Y., Wu, C., Shui, G., et al. (2017) Requirement of cytosolic phospholipase A2γ in lipid droplet formation Biochim. Biophys. Acta, 1862, 692–705.
6) Ramanadham, S., Ali, T., Ashley, J.W., Bone, R.N., Hancock, W.D., & Lei, X. (2015) Calcium-independent phospholipases A2 and their roles in biological processes and diseases J. Lipid Res., 56, 1643–1668.
7) Morgan, N.V., Westaway, S.K., Morton, J.E., Gregory, A., Gissen, P., Sonek, S., Cangul, H., Coryell, J., Canham, N., Nardocci, N., et al. (2006) PLA2G6, encoding a phospholipase A2, is mutated in neurodegenerative disorders with high brain iron Nat. Genet., 38, 752–754.
8) Zhou, Q., Yen, A., Rymarczyk, G., Asai, H., Trengrove, C., Aziz, N., Kirber, M.T., Mostoslavsky, G., Ikezu, T., Wolozin, B., et al. (2016) Impairment of PARK14-dependent Ca2+ signalling is a novel determinant of Parkinson’s disease Nat. Commun., 7, 10332.
9) Malley, K.R., Koroleva, O., Miller, I., Sanishvili, R., Jenkins, C.M., Gross, R.W., & Korolev, S. (2018) The structure of iPLA2β reveals dimeric active sites and suggests mechanisms of regulation and localization Nat. Commun., 9, 765.
10) Liu, X., Moon, S.H., Jenkins, C.M., Sims, H.F., & Gross, R.W. (2016) Cyclooxygenase-2 mediated oxidation of 2-arachidonoyl-lysophospholipids identifies unknown lipid signaling pathways Cell Chem. Biol., 23, 1217–1227.
11) Liu, G.Y., Moon, S.H., Jenkins, C.M., Li, M., Sims, H.F., Guan, S., & Gross, R.W. (2017) The phospholipase iPLA2γ is a major mediator releasing oxidized aliphatic chains from cardiolipin, integrating mitochondrial bioenergetics and signaling J. Biol. Chem., 292, 10672–10684.
12) Mancuso, D.J., Sims, H.F., Yang, K., Kiebish, M.A., Su, X., Jenkins, C.M., Guan, S., Moon, S.H., Pietka, T., Nassir, F., et al. (2010) Genetic ablation of calcium-independent phospholipase A2γ prevents obesity and insulin resistance during high fat feeding by mitochondrial uncoupling and increased adipocyte fatty acid oxidation J. Biol. Chem., 285, 36495–36510.
13) Moon, S.H., Mancuso, D.J., Sims, H.F., Liu, X., Nguyen, A.L., Yang, K., Guan, S., Dilthey, B.G., Jenkins, C.M., Weinheimer, C.J., et al. (2016) Cardiac myocyte-specific knock-out of calcium-independent phospholipase A2γ (iPLA2γ) decreases oxidized fatty acids during ischemia/reperfusion and reducesinfarct size J. Biol. Chem., 291, 19687–19700.
14) Saunders, C.J., Moon, S.H., Liu, X., Thiffault, I., Coffman, K., LePichon, J.B., Taboada, E., Smith, L.D., Farrow, E.G., Miller, N., et al. (2015) Loss of function variants in human PNPLA8 encoding calcium-independent phospholipase A2γ recapitulate the mitochondriopathy of the homologous null mouse Hum. Mutat., 36, 301–306.
15) Quistad, G.B., Barlow, C., Winrow, C.J., Sparks, S.E., & Casida, J.E. (2003) Evidence that mouse brain neuropathy target esterase is a lysophospholipase Proc. Natl. Acad. Sci. USA, 100, 7983–7987.
16) Kienesberger, P.C., Lass, A., Preiss-Landl, K., Wolinski, H., Kohlwein, S.D., Zimmermann, R., & Zechner, R. (2008) Identification of an insulin-regulated lysophospholipase with homology to neuropathy target esterase J. Biol. Chem., 283, 5908–5917.
17) Winrow, C.J., Hemming, M.L., Allen, D.M., Quistad, G.B., Casida, J.E., & Barlow, C. (2003) Loss of neuropathy target esterase in mice links organophosphate exposure to hyperactivity Nat. Genet., 33, 477–485.
18) Akassoglou, K., Malester, B., Xu, J., Tessarollo, L., Rosenbluth, J., & Chao, M.V. (2004) Brain-specific deletion of neuropathy target esterase/swisscheese results in neurodegeneration Proc. Natl. Acad. Sci. USA, 101, 5075–5080.
19) Synofzik, M., Gonzalez, M.A., Lourenco, C.M., Coutelier, M., Haack, T.B., Rebelo, A., Hannequin, D., Strom, T.M., Prokisch, H., Kernstock, C., et al. (2014) PNPLA6 mutations cause Boucher-Neuhauser and Gordon Holmes syndromes as part of a broad neurodegenerative spectrum Brain, 137, 69–77.
20) Kmoch, S., Majewski, J., Ramamurthy, V., Cao, S., Fahiminiya, S., Ren, H., MacDonald, I.M., Lopez, I., Sun, V., Keser, V., et al.; Care4Rare Canada. (2015) Mutations in PNPLA6 are linked to photoreceptor degeneration and various forms of childhood blindness Nat. Commun., 6, 5614.
21) Gallazzini, M., Ferraris, J.D., Kunin, M., Morris, R.G., & Burg, M.B. (2006) Neuropathy target esterase catalyzes osmoprotective renal synthesis of glycerophosphocholine in response to high NaCl Proc. Natl. Acad. Sci. USA, 103, 15260–15265.
22) Haemmerle, G., Moustafa, T., Woelkart, G., Büttner, S., Schmidt, A., van de Weijer, T., Hesselink, M., Jaeger, D., Kienesberger, P.C., Zierler, K., et al. (2011) ATGL-mediated fat catabolism regulates cardiac mitochondrial function via PPAR-α and PGC-1 Nat. Med., 17, 1076–1085.
23) Schreiber, R., Diwoky, C., Schoiswohl, G., Feiler, U., Wongsiriroj, N., Abdellatif, M., Kolb, D., Hoeks, J., Kershaw, E.E., Sedej, S., et al. (2017) Cold-induced thermogenesis depends on ATGL-mediated lipolysis in cardiac muscle, but not brown adipose tissue Cell Metab., 26, 1–11.
24) Haemmerle, G., Lass, A., Zimmermann, R., Gorkiewicz, G., Meyer, C., Rozman, J., Heldmaier, G., Maier, R., Theussl, C., Eder, S., et al. (2006) Defective lipolysis and altered energy metabolism in mice lacking adipose triglyceride lipase Science, 312, 734–737.
25) Fischer, J., Lefèvre, C., Morava, E., Mussini, J.M., Laforêt, P., Negre-Salvayre, A., Lathrop, M., & Salvayre, R. (2007) The gene encoding adipose triglyceride lipase (PNPLA2) is mutated in neutral lipid storage disease with myopathy Nat. Genet., 39, 28–30.
26) Das, S.K., Eder, S., Schauer, S., Diwoky, C., Temmel, H., Guertl, B., Gorkiewicz, G., Tamilarasan, K.P., Kumari, P., Trauner, M., et al. (2011) Adipose triglyceride lipase contributes to cancer-associated cachexia Science, 33, 233–238.
27) Zechner, R., Madeo, F., & Kratky, D. (2017) Cytosolic lipolysis and lipophagy:two sides of the same coin Nat. Rev. Mol. Cell Biol., 18, 671–684.
28) Romeo, S., Kozlitina, J., Xing, C., Pertsemlidis, A., Cox, D., Pennacchio, L.A., Boerwinkle, E., Cohen, J.C., & Hobbs, H.H. (2008) Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease Nat. Genet., 40, 1461–1465.
29) Li, J.Z., Huang, Y., Karaman, R., Ivanova, P.T., Brown, H.A., Roddy, T., Castro-Perez, J., Cohen, J.C., & Hobbs, H.H. (2012) Chronic overexpression of PNPLA3I148M in mouse liver causes hepatic steatosis J. Clin. Invest., 122, 4130–4144.
30) Bruschi, F.V., Claudel, T., Tardelli, M., Caligiuri, A., Stulnig, T.M., Marra, F., & Trauner, M. (2017) The PNPLA3 I148M variant modulates the fibrogenic phenotype of human hepatic stellate cells Hepatol, 65, 1875–1890.
31) Grall, A., Guaguère, E., Planchais, S., Grond, S., Bourrat, E., Hausser, I., Hitte, C., Le Gallo, M., Derbois, C., Kim, G.J., et al. (2012) PNPLA1 mutations cause autosomal recessive congenital ichthyosis in golden retriever dogs and humans Nat. Genet., 44, 140–147.
32) Hirabayashi, T., Anjo, T., Kaneko, A., Senoo, Y., Shibata, A., Takama, H., Yokoyama, K., Nishito, Y., Ono, T., Taya, C., et al. (2017) PNPLA1 has a crucial role in skin barrier function by directing acylceramide biosynthesis Nat. Commun., 8, 14609.
33) Ohno, Y., Kamiyama, N., Nakamichi, S., & Kihara, A. (2017) PNPLA1 is a transacylase essential for the generation of the skin barrier lipid ω-O-acylceramide Nat. Commun., 8, 14610.
34) Dupont, N., Chauhan, S., Arko-Mensah, J., Castillo, E.F., Masedunskas, A., Weigert, R., Robenek, H., Proikas-Cezanne, T., & Deretic, V. (2014) Neutral lipid stores and lipase PNPLA5 contribute to autophagosome biogenesis Curr. Biol., 24, 609–620.
35) Murakami, M., Yamamoto, K., Miki, Y., Murase, R., Sato, H., & Taketomi, Y. (2016) The roles of the secreted phospholipase A2 gene family in immunology Adv. Immunol., 132, 91–134.
36) Murakami, M., Sato, H., Miki, Y., Yamamoto, K., & Taketomi, Y. (2015) A new era of secreted phospholipase A2. J. Lipid Res., 56, 1248–1261.
37) Labonté, E.D., Kirby, R.J., Schildmeyer, N.M., Cannon, A.M., Huggins, K.W., & Hui, D.Y. (2006) Group 1B phospholipase A2-mediated lysophospholipid absorption directly contributes to postprandial hyperglycemia Diabetes, 55, 935–941.
38) Entwistle, L.J., Pelly, V.S., Coomes, S.M., Kannan, Y., Perez-Lloret, J., Czieso, S., Silva Dos Santos, M., MacRae, J.I., Collinson, L., Sesay, A., et al. (2017) Epithelial-cell-derived phospholipase A2 group 1B is an endogenous anthelmintic. Cell Host Microbe, 22, 484–493.
39) Weinrauch, Y., Abad, C., Liang, N.S., Lowry, S.F., & Weiss, J. (1998) Mobilization of potent plasma bactericidal activity during systemic bacterial challenge. Role of group IIA phospholipase A2 J. Clin. Invest., 102, 633–638.
40) Boudreau, L.H., Duchez, A.C., Cloutier, N., Soulet, D., Martin, N., Bollinger, J., Paré, A., Rousseau, M., Naika, G.S., Lévesque, T., et al. (2014) Platelets release mitochondria serving as substrate for bactericidal group IIA-secreted phospholipase A2 to promote inflammation Blood, 124, 2173–2183.
41) MacPhee, M., Chepenik, K.P., Liddell, R.A., Nelson, K.K., Siracusa, L.D., & Buchberg, A.M. (1995) The secretory phospholipase A2 gene is a candidate for the Mom1 locus, a major modifier of ApcMin-induced intestinal neoplasia Cell, 81, 957–966.
42) Schewe, M., Franken, P.F., Sacchetti, A., Schmitt, M., Joosten, R., Böttcher, R., van Royen, M.E., Jeammet, L., Payré, C., Scott, P.M., et al. (2016) Secreted phospholipases A2 are intestinal stem cell niche factors with distinct roles in homeostasis, inflammation, and cancer Cell Stem Cell, 19, 38–51.
43) Zeissig, S., Murata, K., Sweet, L., Publicover, J., Hu, Z., Kaser, A., Bosse, E., Iqbal, J., Hussain, M.M., Balschun, K., et al. (2012) Hepatitis B virus-induced lipid alterations contribute to natural killer T cell-dependent protective immunity Nat. Med., 18, 1060–1068.
44) Miki, Y., Yamamoto, K., Taketomi, Y., Sato, H., Shimo, K., Kobayashi, T., Ishikawa, Y., Ishii, T., Nakanishi, H., Ikeda, K., et al. (2013) Lymphoid tissue phospholipase A2 group IID resolves contact hypersensitivity by driving antiinflammatory lipid mediators J. Exp. Med., 210, 1217–1234.
45) Miki, Y., Kidoguchi, Y., Sato, M., Taketomi, Y., Taya, C., Muramatsu, K., Gelb, M.H., Yamamoto, K., & Murakami, M. (2016) Dual roles of group IID phospholipase A2 in inflammation and cancer J. Biol. Chem., 291, 15588–15601.
46) Vijay, R., Hua, X., Meyerholz, D.K., Miki, Y., Yamamoto, K., Gelb, M., Murakami, M., & Perlman, S. (2015) Critical role of phospholipase A2 group IID in age-related susceptibility to severe acute respiratory syndrome-CoV infection J. Exp. Med., 212, 1851–1868.
47) Takabatake, N., Sata, M., Inoue, S., Shibata, Y., Abe, S., Wada, T., Machiya, J., Ji, G., Matsuura, T., Takeishi, Y., et al. (2005) A novel polymorphism in secretory phospholipase A2-IID is associated with body weight loss in chronic obstructive pulmonary disease Am. J. Respir. Crit. Care Med., 172, 1097–1104.
48) Sato, H., Taketomi, Y., Ushida, A., Isogai, Y., Kojima, T., Hirabayashi, T., Miki, Y., Yamamoto, K., Nishito, Y., Kobayashi, T., et al. (2014) The adipocyte-inducible secreted phospholipases PLA2G5 and PLA2G2E play distinct roles in obesity Cell Metab., 20, 119–132.
49) Zhi, H., Qu, L., Wu, F., Chen, L., & Tao, J. (2015) Group IIE secretory phospholipase A2 regulates lipolysis in adipocytes. Obesity (Silver Spring), 23, 760–768.
50) Yamamoto, K., Miki, Y., Sato, H., Nishito, Y., Gelb, M.H., Taketomi, Y., & Murakami, M. (2016) Expression and function of group IIE phospholipase A2 in mouse skin J. Biol. Chem., 291, 15602–15613.
51) Yamamoto, K., Miki, Y., Sato, M., Taketomi, Y., Nishito, Y., Taya, C., Muramatsu, K., Ikeda, K., Nakanishi, H., Taguchi, R., et al. (2015) The role of group IIF-secreted phospholipase A2 in epidermal homeostasis and hyperplasia J. Exp. Med., 212, 1901–1919.
52) Ilic, D., Bollinger, J.M., Gelb, M., & Mauro, T.M. (2014) sPLA2 and the epidermal barrier Biochim. Biophys. Acta, 1841, 416–421.
53) Yamaguchi, M., Samuchiwal, S.K., Quehenberger, O., Boyce, J.A., & Balestrieri, B. (2018) Macrophages regulate lung ILC2 activation via Pla2g5-dependent mechanisms Mucosal Immunol., in press.
54) Ohta, S., Imamura, M., Xing, W., Boyce, J.A., & Balestrieri, B. (2013) Group V secretory phospholipase A2 is involved in macrophage activation and is sufficient for macrophage effector functions in allergic pulmonary inflammation J. Immunol., 190, 5927–5938.
55) Ohtsuki, M., Taketomi, Y., Arata, S., Masuda, S., Ishikawa, Y., Ishii, T., Takanezawa, Y., Aoki, J., Arai, H., Yamamoto, K., et al. (2006) Transgenic expression of group V, but not group X, secreted phospholipase A2 in mice leads to neonatal lethality because of lung dysfunction J. Biol. Chem., 281, 36420–36433.
56) Giannattasio, G., Fujioka, D., Xing, W., Katz, H.R., Boyce, J.A., & Balestrieri, B. (2010) Group V secretory phospholipase A2 reveals its role in house dust mite-induced allergic pulmonary inflammation by regulation of dendritic cell function J. Immunol., 185, 4430–4438.
57) Balestrieri, B., Maekawa, A., Xing, W., Gelb, M.H., Katz, H.R., & Arm, J.P. (2009) Group V secretory phospholipase A2 modulates phagosome maturation and regulates the innate immune response against Candida albicans J. Immunol., 182, 4891–4898.
58) Boilard, E., Lai, Y., Larabee, K., Balestrieri, B., Ghomashchi, F., Fujioka, D., Gobezie, R., Coblyn, J.S., Weinblatt, M.E., Massarotti, E.M., et al. (2010) A novel anti-inflammatory role for secretory phospholipase A2 in immune complex-mediated arthritis EMBO Mol. Med., 2, 172–187.
59) Henderson, W.R. Jr., Chi, E.Y., Bollinger, J.G., Tien, Y.T., Ye, X., Castelli, L., Rubtsov, Y.P., Singer, A.G., Chiang, G.K., Nevalainen, T., et al. (2007) Importance of group X-secreted phospholipase A2 in allergen-induced airway inflammation and remodeling in a mouse asthma model J. Exp. Med., 204, 865–877.
60) Nolin, J.D., Lai, Y., Ogden, H.L., Manicone, A.M., Murphy, R.C., An, D., Frevert, C.W., Ghomashchi, F., Naika, G.S., Gelb, M.H., et al. (2017) Secreted PLA2 group X orchestrates innate and adaptive immune responses to inhaled allergen JCI Insight, 2, 94929.
61) Hallstrand, T.S., Lai, Y., Altemeier, W.A., Appel, C.L., Johnson, B., Frevert, C.W., Hudkins, K.L., Bollinger, J.G., Woodruff, P.G., Hyde, D.M., et al. (2013) Regulation and function of epithelial secreted phospholipase A2 group X in asthma Am. J. Respir. Crit. Care Med., 188, 42–50.
62) Lai, Y., Oslund, R.C., Bollinger, J.G., Henderson, W.R. Jr., Santana, L.F., Altemeier, W.A., Gelb, M.H., & Hallstrand, T.S. (2010) Eosinophil cysteinyl leukotriene synthesis mediated by exogenous secreted phospholipase A2 group X J. Biol. Chem., 285, 41491–41500.
63) Murase, R., Sato, H., Yamamoto, K., Ushida, A., Nishito, Y., Ikeda, K., Kobayashi, T., Yamamoto, T., Taketomi, Y., & Murakami, M. (2016) Group X secreted phospholipase A2 releases ω3 polyunsaturated fatty acids, suppresses colitis, and promotes sperm fertility J. Biol. Chem., 291, 6895–6911.
64) Escoffier, J., Jemel, I., Tanemoto, A., Taketomi, Y., Payre, C., Coatrieux, C., Sato, H., Yamamoto, K., Masuda, S., Pernet-Gallay, K., et al. (2010) Group X phospholipase A2 is released during sperm acrosome reaction and controls fertility outcome in mice J. Clin. Invest., 120, 1415–1428.
65) Sato, H., Taketomi, Y., Isogai, Y., Miki, Y., Yamamoto, K., Masuda, S., Hosono, T., Arata, S., Ishikawa, Y., Ishii, T., et al. (2010) Group III secreted phospholipase A2 regulates epididymal sperm maturation and fertility in mice J. Clin. Invest., 120, 1400–1414.
66) Taketomi, Y., Ueno, N., Kojima, T., Sato, H., Murase, R., Yamamoto, K., Tanaka, S., Sakanaka, M., Nakamura, M., Nishito, Y., et al. (2013) Mast cell maturation is driven via a group III phospholipase A2-prostaglandin D2-DP1 receptor paracrine axis Nat. Immunol., 14, 554–563.
67) Murase, R., Taketomi, Y., Miki, Y., Nishito, Y., Saito, M., Fukami, K., Yamamoto, K., & Murakami, M. (2017) Group III phospholipase A2 promotes colitis and colorectal cancer Sci. Rep., 7, 12261.
68) Sato, H., Kato, R., Isogai, Y., Saka, G., Ohtsuki, M., Taketomi, Y., Yamamoto, K., Tsutsumi, K., Yamada, J., Masuda, S., et al. (2008) Analyses of group III secreted phospholipase A2 transgenic mice reveal potential participation of this enzyme in plasma lipoprotein modification, macrophage foam cell formation, and atherosclerosis J. Biol. Chem., 283, 33483–33497.
69) Wilensky, R.L., Shi, Y., Mohler, E.R. 3rd, Hamamdzic, D., Burgert, M.E., Li, J., Postle, A., Fenning, R.S., Bollinger, J.G., Hoffman, B.E., et al. (2008) Inhibition of lipoprotein-associated phospholipase A2 reduces complex coronary atherosclerotic plaque development Nat. Med., 14, 1059–1066.
70) Xu, C., Reichert, E.C., Nakano, T., Lohse, M., Gardner, A.A., Revelo, M.P., Topham, M.K., & Stafforini, D.M. (2013) Deficiency of phospholipase A2 group 7 decreases intestinal polyposis and colon tumorigenesis in ApcMin/+ mice Cancer Res., 73, 2806–2816.
71) Kono, N., Inoue, T., Yoshida, Y., Sato, H., Matsusue, T., Itabe, H., Niki, E., Aoki, J., & Arai, H. (2008) Protection against oxidative stress-induced hepatic injury by intracellular type II platelet-activating factor acetylhydrolase by metabolism of oxidized phospholipids in vivo J. Biol. Chem., 283, 1628–1636.
72) Shimanaka, Y., Kono, N., Taketomi, Y., Arita, M., Okayama, Y., Tanaka, Y., Nishito, Y., Mochizuki, T., Kusuhara, H., Adibekian, A., et al. (2017) Omega-3 fatty acid epoxides are autocrine mediators that control the magnitude of IgE-mediated mast cell activation Nat. Med., 23, 1287–1297.
73) Koizumi, H., Yamaguchi, N., Hattori, M., Ishikawa, T.O., Aoki, J., Taketo, M.M., Inoue, K., & Arai, H. (2003) Targeted disruption of intracellular type I platelet activating factor-acetylhydrolase catalytic subunits causes severe impairment in spermatogenesis J. Biol. Chem., 278, 12489–12494.
74) Hiraoka, M., Abe, A., Lu, Y., Yang, K., Han, X., Gross, R.W., & Shayman, J.A. (2006) Lysosomal phospholipase A2 and phospholipidosis Mol. Cell. Biol., 26, 6139–6148.
75) Paduraru, C., Bezbradica, J.S., Kunte, A., Kelly, R., Shayman, J.A., Veerapen, N., Cox, L.R., Besra, G.S., & Cresswell, P. (2013) Role for lysosomal phospholipase A2 in iNKT cell-mediated CD1d recognition Proc. Natl. Acad. Sci. USA, 110, 5097–5102.
76) Jaworski, K., Ahmadian, M., Duncan, R.E., Sarkadi-Nagy, E., Varady, K.A., Hellerstein, M.K., Lee, H.Y., Samuel, V.T., Shulman, G.I., Kim, K.H., et al. (2009) AdPLA ablation increases lipolysis and prevents obesity induced by high-fat feeding or leptin deficiency Nat. Med., 15, 159–168.
77) Uyama, T., Kawai, K., Kono, N., Watanabe, M., Tsuboi, K., Inoue, T., Araki, N., Arai, H., & Ueda, N. (2015) Interaction of Phospholipase A/Acyltransferase-3 with Pex19p:a possible involvement in the down-regulation of peroxisomes J. Biol. Chem., 290, 17520–17534.
78) Staring, J., von Castelmur, E., Blomen, V.A., van den Hengel, L.G., Brockmann, M., Baggen, J., Thibaut, H.J., Nieuwenhuis, J., Janssen, H., van Kuppeveld, F.J., et al. (2017) PLA2G16 represents a switch between entry and clearance of Picornaviridae Nature, 541, 412–416.
79) Long, J.Z., Cisar, J.S., Milliken, D., Niessen, S., Wang, C., Trauger, S.A., Siuzdak, G., & Cravatt, B.F. (2011) Metabolomics annotates ABHD3 as a physiologic regulator of medium-chain phospholipids Nat. Chem. Biol., 7, 763–765.
80) Lee, H.C., Simon, G.M., & Cravatt, B.F. (2015) ABHD4 regulates multiple classes of N-acyl phospholipids in the mammalian central nervous system Biochemistry, 54, 2539–2549.
81) Kamat, S.S., Camara, K., Parsons, W.H., Chen, D.H., Dix, M.M., Bird, T.D., Howell, A.R., & Cravatt, B.F. (2015) Immunomodulatory lysophosphatidylserines are regulated by ABHD16A and ABHD12 interplay Nat. Chem. Biol., 11, 164–171.
82) Blankman, J.L., Long, J.Z., Trauger, S.A., Siuzdak, G., & Cravatt, B.F. (2013) ABHD12 controls brain lysophosphatidylserine pathways that are deregulated in a murine model of the neurodegenerative disease PHARC Proc. Natl. Acad. Sci. USA, 110, 1500–1505.
83) Lass, A., Zimmermann, R., Haemmerle, G., Riederer, M., Schoiswohl, G., Schweiger, M., Kienesberger, P., Strauss, J.G., Gorkiewicz, G., & Zechner, R. (2006) Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman Syndrome Cell Metab., 3, 309–319.