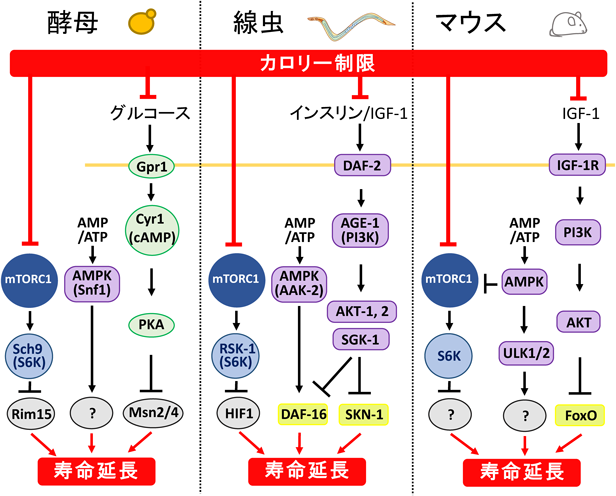
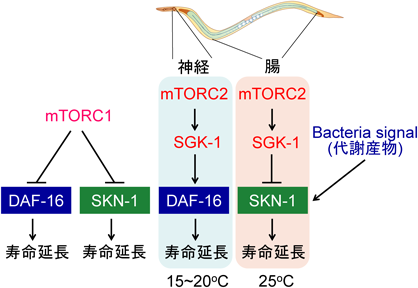
栄養・代謝センシング経路による寿命制御機構Nutrients- and metabolites-sensing pathways regulate lifespan
広島大学大学院先端物質科学研究科分子生命機能科学専攻Department of Molecular Biotechnology, Graduate School of Advanced and Sciences of Matter ◇ 〒739–8530 広島県東広島市鏡山1–3–1 ◇ 1–3–1 Kagamiyama, Higashi-Hiroshima, Hiroshima 739–8530, Japan