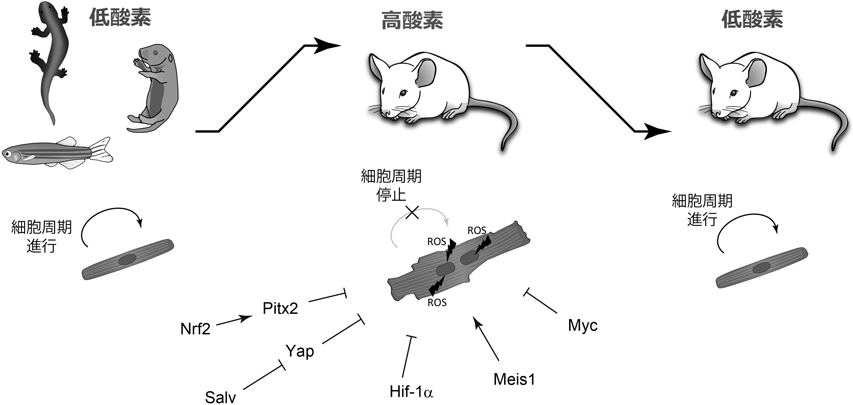
酸素代謝による心筋細胞の細胞周期制御と心臓再生Oxidative Metabolism Regulates Cardiomyocyte Cell Cycle and Cardiac Regeneration
理化学研究所生命機能科学研究センター心臓再生研究チームRIKEN Center for Biosystems Dynamics Research ◇ 〒650–0047 兵庫県神戸市中央区港島南町2–2–3 ◇ 2–2–3 Minatojima-Minamimachi, Chuo-ku, Kobe, Hyogo 650–0047