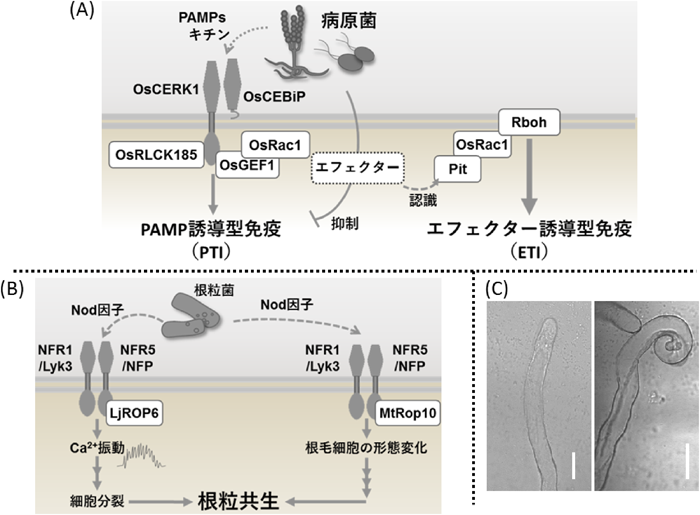
植物–微生物相互作用を制御する低分子量Gタンパク質Rac/ROPの役割The role of the small GTPase Rac/ROP in plant-microbe interactions
関西学院大学理工学部生命科学科植物共生工学研究室Department of Bioscience, Kwansei Gakuin University ◇ 〒669–1337 兵庫県三田市学園2–1 関西学院大学理工学部生命科学科 ◇ 2–1 Gakuen, Sanda 669–1337, Japan