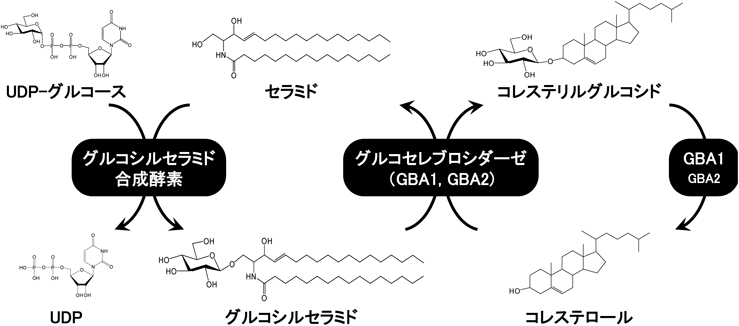
グルコセレブロシダーゼによるステリルグルコシドの代謝制御機構Regulatory mechanism of sterylglucoside metabolism by glucocerebrosidase
理化学研究所・脳神経科学研究センター・神経細胞動態研究チーム,理化学研究所・佐甲細胞情報研究室Laboratory for Neural Cell Dynamics, Center for Brain Science, RIKEN, Cellular Informatics Laboratory, RIKEN ◇ 〒351–0198 埼玉県和光市広沢2–1 ◇ 2–1, Hirosawa, Wako, Saitama 351–0198, Japan