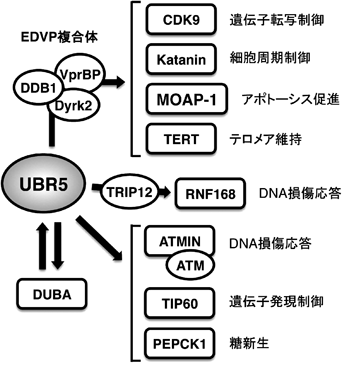
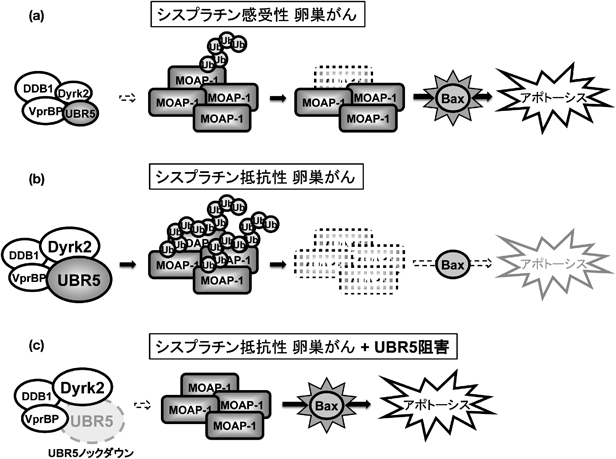
ユビキチンリガーゼUBR5を介したがん細胞の薬剤抵抗性獲得機構Ubiquitin ligase UBR5 regulates chemotherapeutic resistance in cancer
Department of Pharmacology and Cancer Biology, Duke University Medical CenterDepartment of Pharmacology and Cancer Biology, Duke University Medical Center ◇ C364 LSRC, 308 Research Drive, Box 3813, Durham, North Carolina, 27710, USA ◇ C364 LSRC, 308 Research Drive, Box 3813, Durham, North Carolina, 27710, USA