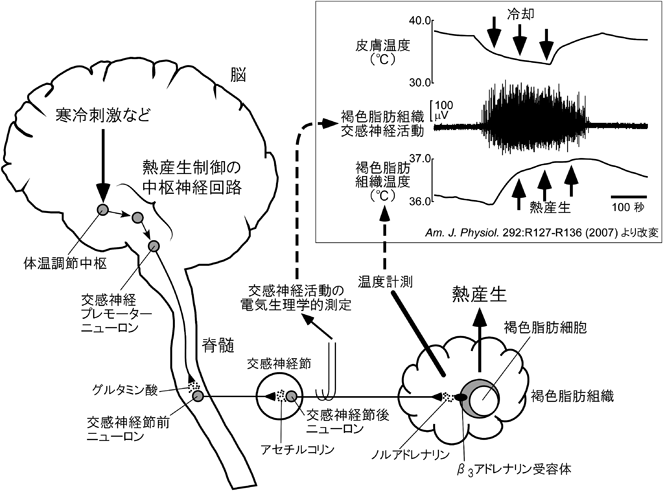
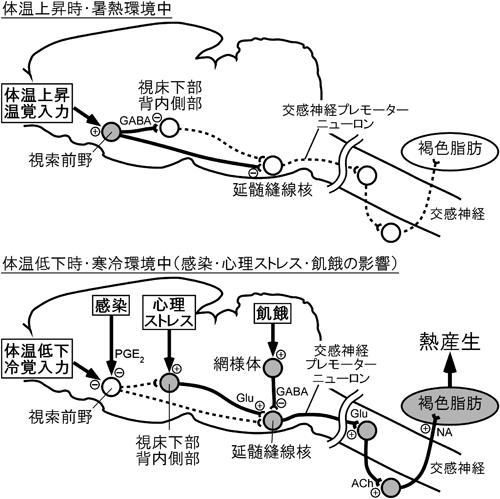
多様な環境ストレスに応じた褐色脂肪熱産生調節の中枢メカニズムCentral mechanisms for regulation of brown fat thermogenesis in response to a variety of environmental stressors
名古屋大学大学院医学系研究科統合生理学分野Department of Integrative Physiology, Nagoya University Graduate School of Medicine ◇ 〒466–8550 愛知県名古屋市昭和区鶴舞町65 ◇ Tsurumai-cho 65, Showa-ku, Nagoya, Aichi 466–8550, Japan