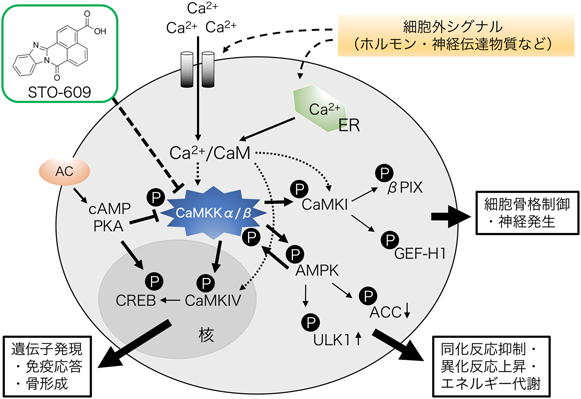
ほぼすべての細胞において,遊離の細胞内カルシウムイオン(Ca2+)はセカンドメセンジャーとして細胞内情報伝達を調節し,筋収縮,代謝制御,免疫応答から神経機能に至る多様な細胞応答を制御する.通常100 nM以下に保たれている細胞質のCa2+濃度は,細胞外からの刺激により1 µM以上に上昇する.このCa2+ダイナミクスは細胞外や小胞体(ER),筋小胞体(SR),ミトコンドリアなどの細胞内Ca2+貯蔵小器官からの流入や排出により厳密に制御されている1).Ca2+の生体における多機能性はカルモデュリン(calmodulin:CaM)に代表されるCa2+結合タンパク質とその下流に位置する細胞内酵素,受容体,細胞骨格など標的タンパク質とのCa2+依存的な相互作用と,それらの時空間的制御機構により獲得される2).CaMはEF-ハンドCa2+結合構造を四つ持つダンベル型のCa2+情報伝達分子であり,その研究の歴史は70年代の垣内史郎教授(大阪大学)とWai Y. Cheung教授(セント・ジュード小児研究病院)による発見にまで遡る3, 4).現在までに100種類を超えるCaM相互作用分子が同定されており,プロテオーム解析などの網羅的同定法によりCaMを介したCa2+情報伝達機構の多様性はさらに広がりを見せている5).中でもタンパク質リン酸化反応はCa2+情報伝達経路においても細胞内シグナルの増幅,時空間的制御などの点から中心的な役割を担う生化学的反応であり,Ca2+/CaM依存性タンパク質リン酸化酵素(CaMキナーゼ)により触媒される6).本酵素はその基質特異性から,生理機能の限定した酵素群と幅広い基質特異性を持つ多機能性CaMキナーゼに区分される.前者として,δサブユニットにCaMを持つホスホリラーゼキナーゼは最も古く見いだされたCaMキナーゼの一つであり,グリコーゲン分解を促進する7).ミオシン軽鎖キナーゼ(myosin light chain kinase:MLCK)は平滑筋収縮のCa2+調節を担う酵素であり,骨格筋にも存在するがその機能についてはいまだ不明である8, 9).一方,多機能性CaMキナーゼとして10~12量体構造を持ち神経細胞のシナプス後肥厚の2%のタンパク質量を占めるCaMキナーゼII(CaMKII)は,記憶・学習などの高次中枢神経機能に深く関与する10, 11).また単量体の多機能性CaMキナーゼとして,CaMキナーゼI(CaMKI)12–15)や核局在を示すCaMキナーゼIV(CaMKIV)16)が知られている.一般的にCa2+/CaM依存性酵素はCa2+/CaM複合体の高親和性結合と,それに伴うアロステリックな調節作用により酵素活性が発現する.一方,多機能性CaMキナーゼであるCaMKIおよびCaMKIVはCa2+/CaM結合とともに,その触媒領域内に位置する活性化ループのThr残基(Thr177:CaMKIα, Thr196:CaMKIV)が上流キナーゼ(CaMKK)によりリン酸化され,酵素触媒能力は10~30倍上昇する17, 18).すなわちCaMKI/IVを介したCa2+シグナル伝達経路にはCaMKKによるリン酸化制御が不可欠であり,“CaMキナーゼカスケード”反応と呼ばれる(図1).近年,代謝調節に重要な5′-AMP活性化キナーゼ(5′-AMP-activated protein kinase:AMPK)がCaMKKのアイソフォームの一つCaMKKβによりリン酸化依存的に活性化されることが見いだされた19–21).このCaMKKβ/AMPK経路は代謝調節のみならず,がん細胞増殖など病態との関連も報告されており,これらのシグナル伝達を分子標的とする創薬も期待される.そこで,本稿ではCaMKKの機能調節の分子機構から,その阻害薬,さらにはCaMKKを介したシグナル伝達経路の制御メカニズムについて解説する.
2. Ca2+/calmodulin-dependent protein kinase kinase(CaMKK)
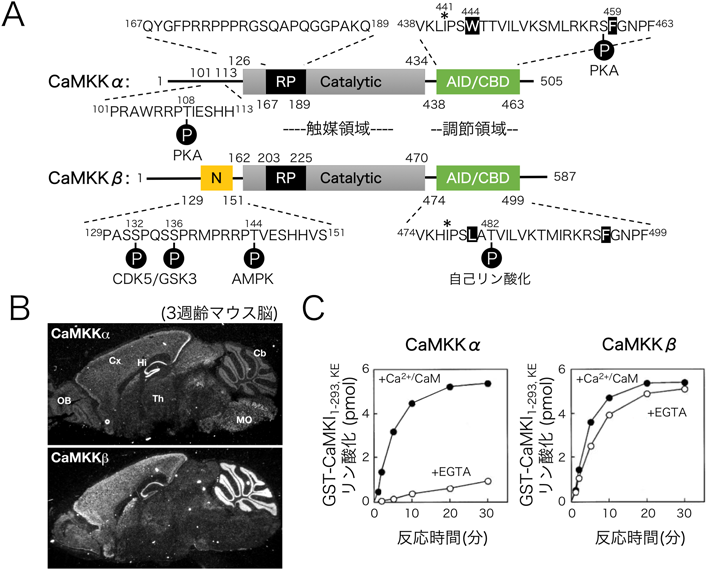
Ca2+/カルモデュリン依存性プロテインキナーゼキナーゼ(Ca2+/calmodulin-dependent protein kinase kinase:CaMKK)は1993年に藤澤仁教授(旭川医科大学)のグループにより,ラット脳抽出液中のリン酸化酵素と推定されるCaMKIV活性化因子として,その存在が初めて報告された22).翌年,著者らはラット脳より68 kDaのCaMKIV活性化リン酸化酵素を単離精製し,1995年に精製酵素から決定した部分アミノ酸配列をもとにcDNAクローニングに成功し,推定一次配列からこのリン酸化酵素が505アミノ酸残基からなるタンパク質リン酸化酵素であることを明らかにした17, 18).CaMKIV活性化キナーゼの組換え体酵素は,CaMKIVのみならずCaMKIのリン酸化酵素活性も飛躍的に上昇させることから,Ca2+/calmodulin-dependent protein kinase kinase(CaMKK)と名づけられた17, 18).なおCaMKKはそれ自体もCaMキナーゼである23).この遺伝子産物は後にCaMKKアイソフォームの一つであるCaMKKα(CaMKK1)であることが明らかとなる.その後,CaMKKβ(CaMKK2)アイソフォームのcDNAがクローニングされた.CaMKKβは触媒領域から調節領域に至るまでCaMKKαと約70%の相同性を有し,CaMKIおよびCaMKIVの活性化という機能的類似性も示された24, 25)(図2A).CaMKKα, βともに全身に発現し,特に中枢神経系には豊富に存在する.またαアイソフォームは脾臓,膵臓にもmRNA発現がみられる18, 25, 26).中枢神経系において,CaMKKαは大脳皮質,海馬に豊富に存在し,CaMKKβは小脳顆粒層における発現が特徴的であり,大脳皮質,海馬にもみられる(図2B)26, 27)ことからも中枢神経機能への役割が示唆された.確かにCaMKKα遺伝子欠損マウスはオスのみ文脈的恐怖記憶が損なわれており28),CaMKKβ欠損マウスではcAMP応答配列結合タンパク質(cAMP-response element binding protein:CREB)リン酸化の減少とともに空間記憶が損なわれ,海馬CA1シナプスにおける後期の長期増強(LTP)も消失する29).一方,脊椎動物以外の真核生物においてもCaMKKの保存性は高く,下流CaMキナーゼの活性化を指標にすると線虫CKK-130)や糸状菌CMKC31)にまでみられる.分裂酵母Ssp1も触媒領域の高い相同性とAMPK触媒サブユニット(Ssp2)に対する活性化リン酸化能を有することが報告されているが32, 33),酵素活性発現におけるCa2+/CaM要求性については不明である.
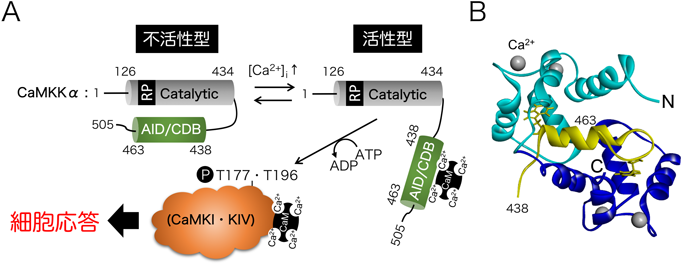
CaMKKαおよびβはともに,N末端領域の触媒領域(CaMKKα:126~434, CaMKKβ:162~470)とそれに続くCa2+/CaM結合領域を含む調節領域(CaMKKα:438~463, CaMKKβ:474~499)をリン酸化酵素のコアとして有する(図2A)34).CaMKK触媒領域内には,Arg/Pro残基に富んだ特徴的な23アミノ酸残基の挿入領域(RP領域)が存在する.RP領域の欠失は自己リン酸化やペプチド基質に対するリン酸化能力には影響を与えないが,CaMKIやCaMKIVの活性化能を失うことから,この領域が標的CaMキナーゼに対する特異的な基質認識に重要と考えられる35).他のCaMキナーゼと同様にCaMKK自身も細胞内Ca2+濃度が低い場合には,その自己阻害領域(AID)を含んだ調節領域(CaMKKα:438~463, CaMKKβ:474~499)によりリン酸化酵素活性を不活性に保つ.特にIle441(CaMKKα)はこの自己阻害に重要である(図2A)36).一方,活性化因子であるCa2+/CaMはこの自己阻害領域に重複した結合領域(CBD)に結合することにより,阻害領域による活性阻害機能を解除させることでCaMKK活性を発現する(図3A).伊倉光彦教授(トロント大学)らのグループによるNMRを用いた構造解析から,CaMKKαの調節領域ペプチド(CaMKKα:438~463)とCa2+/CaMとの複合体構造が明らかとなった37)(図3B).これによると,複合体構造には調節領域N末端部分のα-ヘリックス構造とそれに続くループ構造がみられ,Trp444とPhe459がCa2+/CaMのN末端,C末端の疎水性ポケットに入り込むことにより,複合体構造を安定化させる(図2A,図3B)37).興味深いことにCa2+/CaMのCaMKKαペプチド(438~463)への結合方向性はMLCKやCaMKIIのそれと逆向きである.しかし,MLCK, CaMKIIのCaM結合配列をCaMKKαのそれと交換したCaMKKα変異体の酵素活性の発現は完全にCa2+/CaMに依存していることから,CaMキナーゼにおけるCa2+/CaM結合による活性化機構にはCa2+/CaMの結合方向性は大きな意味を持たないのかもしれない36).またこの調節領域を欠いた恒常的活性型CaMKKα(1~433)の遺伝子導入マウスは,短期記憶に変化がないものの海馬における長期記憶が選択的に損なわれることから,CaMKKαのCa2+/CaMによる厳密な活性制御機構が長期記憶にとっても重要と考えられる38).
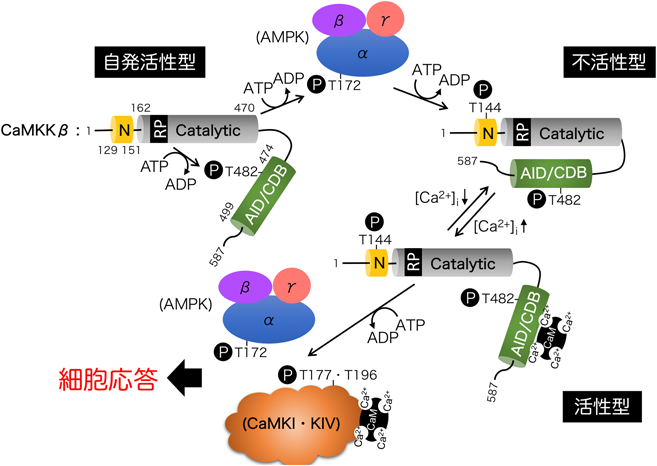
厳密なCa2+/CaM要求性を持つCaMKKαとは対照的に,CaMKKβ組換え体酵素は高いCa2+/CaM非依存性活性[自発活性(autonomous activity)]を発現することが知られており(図2C)24, 25, 34),Ca2+/CaM存在下における総リン酸化活性の70~80%に達する.CaMKKαと相同かつ機能的な調節領域(474~499)を有するにも関わらず(図2A),CaMKKβの自己阻害機構(Ca2+/CaM非存在下における酵素活性抑制)は見かけ上機能していない.これは触媒領域(162~470)のN末端付近に位置する短い領域(N末端調節領域:129~151)によることが,この領域を欠失させた変異体CaMKKβΔ129-151が完全にCa2+/CaM依存性酵素になることから明らかとなった(図2A)34).また,CaMKKβはこの自発活性に由来する高い自己リン酸化反応が観察され,特に調節領域(474~499)内のThr482の自己リン酸化は自発活性の発現にも一定程度貢献している(図2A,図4)39).さらにCaMKKβはCaMKKαと異なり,細胞内においてAMPKを標的リン酸化基質としてαサブユニットのThr172のリン酸化依存的な活性化を触媒する19–21).AMPKに対するKm値はCaMKKβとCaMKKαではそれぞれ1.5 µMと13.1 µMと約9倍程度見かけ上の基質親和性に差があり,この差が,CaMKKβ/AMPK経路を成立させている一因と考えられる40).
現在までにCaMKKを活性化する上流リン酸化酵素に関する報告はない.一方,自己リン酸化とは別に細胞内において,このCa2+シグナル伝達機構はcAMP/PKA経路によるリン酸化反応により制御される.CaMKKαは触媒領域外側のThr108とCa2+/CaM結合領域内のSer458のcAMP依存性リン酸化酵素(cAMP-dependent protein kinase:PKA)によるリン酸化(図2A)がCaMKK活性を負に調節していることが,PC12細胞,海馬神経細胞やJurkat T-細胞において見いだされている41, 42).さらにこれらPKAによるCaMKKαのリン酸化は14-3-3タンパク質を呼び込むことにより,Thr108の脱リン酸化を抑制することで,不活性化状態を保持する43, 44).また最近著者らは,CaMKKβ/AMPK活性化経路において,下流AMPKがCaMKKβをフィードバックリン酸化することを見いだした45).CaMKKβによりThr172をリン酸化依存的に活性化したAMPKはCaMKKβのN末端調節領域(129~151)に存在するThr144をリン酸化し,このリン酸化がN末端調節領域の役割である自己抑制機構の解除機能34)を抑制することで,CaMKKβをCa2+/CaM依存性酵素へと変換する(図4).このリン酸化制御は培養細胞においても観察され,CaMKKβ/AMPK経路の活性化に細胞内Ca2+濃度の上昇を必要とするためには,CaMKKβのThr144のリン酸化を介したCa2+/CaM依存性酵素への機能変換が必要なのかもしれない.一方,このN末端調節領域内のリン酸化反応については,サイクリン依存性キナーゼ5(cyclin-dependent kinase 5:CDK5)とグリコーゲン合成酵素キナーゼ3(glycogen synthase kinase 3:GSK3)によるSer128, Ser132, Ser136のリン酸化によりCaMKKβの自発活性が抑制されることが報告されており46)(図2A),N末端調節領域のリン酸化による制御機構の点において類似している.
6. CaMKK阻害剤STO-609と分子薬理学的解析
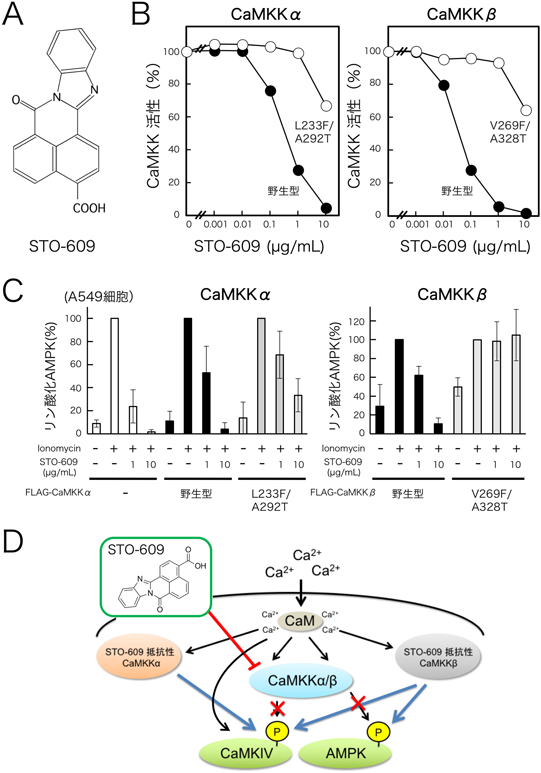
著者らはCaMKKシグナル伝達機構の生理機能解明のため,CaMKK阻害剤STO-609(7H-benzimidazo[2,1-a]benz[de]isoquinoline-7-one-3-carboxylic acid)を2002年に住友製薬(当時)との共同研究により開発した47).STO-609は現在,広く入手可能となっている(図5A, B).STO-609は細胞膜透過性を有する基質ATPの競合阻害剤として,CaMKKαに対してはKi=80 ng/mL,CaMKKβに対してはKi=15 ng/mLの阻害効率を有する.CaMキナーゼ間においては選択性を持つものの,ATP拮抗薬であること,細胞外シグナル制御キナーゼ8(extracellular signal-regulated kinase 8:ERK8),カゼインキナーゼ2(casein kinase 2:CK2)やMAPキナーゼ相互作用キナーゼ1(MAPK-interacting protein kinase 1:MNK1)などに対する阻害効果48)や芳香族炭化水素受容体に対するアゴニスト作用49)も報告されており,STO-609の薬理学的作用に関しては,十分な検討と評価を必要とする.興味深いことに,CaMKKアイソフォーム間に対するSTO-609の阻害効率は5~10倍程度の差がみられる(図5B).この差は触媒領域に存在する1アミノ酸残基(Leu233:CaMKKα, Val269:CaMKKβ)側鎖によるSTO-609に対する立体障害の違いであることが推定された50).これはCaMKKβ/STO-609複合体の結晶構造解析51)より明らかとなったVal269(ヒトCaMKKβ:Val270)の主鎖とSTO-609間の水素結合からも強く示唆された.さらに,このアミノ酸残基を立体障害の大きい側鎖を持つアミノ酸残基に置換したSTO-609低感受性変異体は,STO-609の細胞における薬理学的評価に役立つものとなった.STO-609添加による神経細胞の軸索伸長阻害は,STO-609低感受性変異体CaMKKα(Leu233Phe)および恒常的活性型CaMKIαの共発現による回復実験から,CaMKKを介したCaMKIシグナル伝達の抑制によることが示された52).さらに,著者らはSTO-609を用いることでCaMKKアイソフォーム特異的なシグナル伝達経路を区別するために,さらなるSTO-609低感受性CaMKKα(Leu233Phe/Ala292Thr)およびCaMKKβ(Val269Phe/Ala328Thr)を作製した(図5B).これらを安定発現させたA549ヒト肺胞基底上皮腺がん細胞を用いて,細胞内Ca2+濃度上昇に応答したAMPKの活性化リン酸化(Thr172)はCaMKKαではなくCaMKKβにより引き起こされることを確認した(図5C)53).一方,これら変異体安定発現細胞を用いることで,CaMKKα, βともに細胞内においてCaMKIV活性化酵素となることも明らかにした.すなわち,STO-609低感受性CaMKK変異体による回復実験によりSTO-609の薬理効果とCaMKKアイソフォーム特異性についての評価が可能となった(図5D).
7. CaMKK/CaMKIVリン酸化カスケード反応の生理機能
核局在を示すCaMKIVは,CREBや血清応答因子(serum response factor:SRF)などの転写因子のリン酸化を介した遺伝子発現調節への役割が示された16, 54–57).Importin αにより核内移行するCaMKIV58)はCaMKKによるThr196のリン酸化により,リン酸化基質に対する見かけ上の親和性を約10倍程度上昇させることで,酵素活性を上昇させる.また非リン酸化CaMKIVにはみられないCa2+/CaM非依存性活性(自発活性)がThr196のリン酸化により発現する17).この自発活性の発現は,CaMKIIにみられる酵素特性であり,一過性のCa2+シグナルを自発活性の発現を通して長期にわたるリン酸化反応シグナルとして伝達するものである59).しかし,自己阻害領域内のThr286(CaMKIIα)の自己リン酸化による自己抑制機構の解除60)とは異なり,CaMKIVはその触媒領域内のThr196がリン酸化されることにより,自己抑制領域の酵素触媒領域への分子内相互作用が抑制されることで,自発活性が発現する61).また最近ではERストレス下においてCaMKIV触媒領域のCys198のポリスルフィド化による可逆的な新たな活性制御も見いだされた62).神経細胞におけるCaMKK/CaMKIVの役割として,CREBのSer133のリン酸化を介した遺伝子発現制御は長期記憶の形成に重要であり56, 63),CaMKIV遺伝子欠損マウスにおいてはPurkinje細胞における後期の長期抑圧(LTD)の消失や脱分極によるCREBリン酸化レベルの上昇が観察できない64).また詳細な行動解析よりCaMKIV遺伝子欠損マウスは受動回避試験や空間認識においては正常であるものの,長期の恐怖記憶や不安様行動が軽度に減少する65).CaMKIVはT細胞にも発現しており,T細胞受容体の刺激に応答して活性化し66),AP-1(activator protein 1, Fos/Jun)のDNA結合および転写活性を上昇させることでインターロイキン2の発現誘導に関与することからも,免疫応答における重要性も示されている67).このCaMKK/CaMKIV/CREB経路はNFATc1(nuclear factor of activated T cells c1)の発現誘導を介した破骨細胞分化を制御し68),膵臓β細胞や下垂体腫瘍細胞株などの内分泌系細胞においても,インスリンやプロラクチンなどの遺伝子発現を調節する69–71).以上のことからも,CaMKK/CaMKIV経路は生体内において幅広く細胞内Ca2+動員に伴う遺伝子発現制御を担う(図1).
8. CaMKK/CaMKIリン酸化カスケード反応の生理機能
α, β, γ, δのアイソフォームを持つCaMKIも12–15),活性化ループに存在するThr残基のCaMKKによるリン酸化を介して酵素活性が上昇するが,リン酸化CaMKIVと異なり,Ca2+/CaM非依存性活性は認められない.CaMKK/CaMKIカスケードは線虫にまでみられ,CKK-1によるCMK-1のThr179のリン酸化を介したCa2+/CaM依存的な活性化機構は哺乳動物のCaMKK/CaMKIカスケード反応と同様である30, 72).一方,CMK-1はN末端の核移行シグナルによる核局在により,線虫CREB(CRH-1)のSer29のリン酸化を介した転写制御への関与が個体レベルで明らかとなった.線虫には哺乳動物CaMKIVの相同遺伝子がないことからも,このCKK-1/CMK-1/CRH-1経路がCaMKK/CaMKIV/CREB依存性転写調節機構として,感覚神経や介在神経において機能しているようである30).またCKK-1/CMK-1経路は熱回避行動の制御に関与していることが報告されている73).哺乳動物のCaMKK/CaMKI経路は神経細胞における軸索伸長や樹状突起形成などの形態制御を担う74, 75).CaMKKはNMDA(N-methyl-D-aspartate)受容体,AMPA(α-amino-3-hydroxyl-5-methyl-4-isoxazole propionate)受容体,GABA(γ-aminobutyric acid)受容体,さらにはBDNF(brain-derived neurotrophic factor)やニュートロフィン3を介した細胞内Ca2+濃度上昇により活性化され,CaMKIαを介してスパインの形成,シナプスの可塑性や軸索伸長などを制御する(図1)76–79).
引用文献References
1) Berridge, M.J., Lipp, P., & Bootman, M.D. (2000) The versatility and universality of calcium signalling Nat. Rev. Mol. Cell Biol., 1, 11–21.
2) Van Eldik, L.J. & Watterson, D.M. (1998) Calmodulin and Calcium Signal Transduction:An Introduction, Academic Press, New York, 1–15.
3) Kakiuchi, S. & Yamazaki, R. (1970) Calcium dependent phosphodiesterase activity and its activating factor (PAF) from brain studies on cyclic 3′,5′-nucleotide phosphodiesterase (3) Biochem. Biophys. Res. Commun., 41, 1104–1110.
4) Cheung, W.Y. (1970) Cyclic 3′,5′-nucleotide phosphodiesterase. Demonstration of an activator Biochem. Biophys. Res. Commun., 38, 533–538.
5) Berggård, T., Arrigoni, G., Olsson, O., Fex, M., Linse, S., & James, P. (2006) 140 mouse brain proteins identified by Ca2+-calmodulin affinity chromatography and tandem mass spectrometry J. Proteome Res., 5, 669–687.
6) Soderling, T.R. & Stull, J.T. (2001) Structure and regulation of calcium/calmodulin-dependent protein kinases Chem. Rev., 101, 2341–2352.
7) Cohen, P., Burchell, A., Foulkes, J.G., Cohen, P.T., Vanaman, T.C., & Nairn, A.C. (1978) Identification of the Ca2+-dependent modulator protein as the fourth subunit of rabbit skeletal muscle phosphorylase kinase FEBS Lett., 92, 287–293.
8) Adelstein, R.S. & Klee, C.B. (1981) Purification and characterization of smooth muscle myosin light chain kinase J. Biol. Chem., 256, 7501–7509.
9) Nagamoto, H. & Yagi, K. (1984) Properties of myosin light chain kinase prepared from rabbit skeletal muscle by an improved method J. Biochem., 95, 1119–1130.
10) Petersen, J.D., Chen, X.B., Vinade, L., Dosemeci, A., Lisman, J.E., & Reese, T.S. (2003) Distribution of postsynaptic density (PSD)-95 and Ca2+/calmodulin-dependent protein kinase II at the PSD J. Neurosci., 23, 11270–11278.
11) Lisman, J. (2017) Criteria for identifying the molecular basis of the engram (CaMKII, PKMzeta) Mol. Brain, 10, 55.
12) Picciotto, M.R., Czernik, A.J., & Nairn, A.C. (1993) Calcium/calmodulin-dependent protein kinase I. cDNA cloning and identification of autophosphorylation site J. Biol. Chem., 268, 26512–26521.
13) Yokokura, H., Terada, O., Naito, Y., & Hidaka, H. (1997) Isolation and comparison of rat cDNAs encoding Ca2+/calmodulin-dependent protein kinase I isoforms Biochim. Biophys. Acta, 1338, 8–12.
14) Takemoto-Kimura, S., Terai, H., Takamoto, M., Ohmae, S., Kikumura, S., Segi, E., Arakawa, Y., Furuyashiki, T., Narumiya, S., & Bito, H. (2003) Molecular cloning and characterization of CLICK-III/CaMKIγ, a novel membrane-anchored neuronal Ca2+/calmodulin-dependent protein kinase (CaMK) J. Biol. Chem., 278, 18597–18605.
15) Ishikawa, Y., Tokumitsu, H., Inuzuka, H., Murata-Hori, M., Hosoya, H., & Kobayashi, R. (2003) Identification and characterization of novel components of a Ca2+/calmodulin-dependent protein kinase cascade in HeLa cells FEBS Lett., 550, 57–63.
16) Ohmstede, C.A., Jensen, K.F., & Sahyoun, N.E. (1989) Ca2+/calmodulin-dependent protein kinase enriched in cerebellar granule cells. Identification of a novel neuronal calmodulin-dependent protein kinase J. Biol. Chem., 264, 5866–5875.
17) Tokumitsu, H., Brickey, D.A., Glod, J., Hidaka, H., Sikela, J., & Soderling, T.R. (1994) Activation mechanisms for Ca2+/calmodulin-dependent protein kinase IV. Identification of a brain CaM-kinase IV kinase J. Biol. Chem., 269, 28640–28647.
18) Tokumitsu, H., Enslen, H., & Soderling, T.R. (1995) Characterization of a Ca2+/calmodulin-dependent protein kinase cascade. Molecular cloning and expression of calcium/calmodulin-dependent protein kinase kinase J. Biol. Chem., 270, 19320–19324.
19) Woods, A., Dickerson, K., Heath, R., Hong, S.P., Momcilovic, M., Johnstone, S.R., Carlson, M., & Carling, D. (2005) Ca2+/calmodulin-dependent protein kinase kinase-β acts upstream of AMP-activated protein kinase in mammalian cells Cell Metab., 2, 21–33.
20) Hawley, S.A., Pan, D.A., Mustard, K.J., Ross, L., Bain, J., Edelman, A.M., Frenguelli, B.G., & Hardie, D.G. (2005) Calmodulin-dependent protein kinase kinase-β is an alternative upstream kinase for AMP-activated protein kinase Cell Metab., 2, 9–19.
21) Hurley, R.L., Anderson, K.A., Franzone, J.M., Kemp, B.E., Means, A.R., & Witters, L.A. (2005) The Ca2+/calmodulin-dependent protein kinase kinases are AMP-activated protein kinase kinases J. Biol. Chem., 280, 29060–29066.
22) Okuno, S. & Fujisawa, H. (1993) Requirement of brain extract for the activity of brain calmodulin-dependent protein kinase IV expressed in Escherichia coli J. Biochem., 114, 167–170.
23) Tokumitsu, H. & Soderling, T.R. (1996) Requirements for calcium and calmodulin in the calmodulin kinase activation cascade J. Biol. Chem., 271, 5617–5622.
24) Kitani, T., Okuno, S., & Fujisawa, H. (1997) Molecular cloning of Ca2+/calmodulin-dependent protein kinase kinase β J. Biochem., 122, 243–250.
25) Anderson, K.A., Means, R.L., Huang, Q.H., Kemp, B.E., Goldstein, E.G., Selbert, M.A., Edelman, A.M., Fremeau, R.T., & Means, A.R. (1998) Components of a calmodulin-dependent protein kinase cascade. Molecular cloning, functional characterization and cellular localization of Ca2+/calmodulin-dependent protein kinase kinase β J. Biol. Chem., 273, 31880–31889.
26) Sakagami, H., Umemiya, M., Saito, S., & Kondo, H. (2000) Distinct immunohistochemical localization of two isoforms of Ca2+/calmodulin-dependent protein kinase kinases in the adult rat brain Eur. J. Neurosci., 12, 89–99.
27) Kamata, A., Sakagami, H., Tokumitsu, H., Sanda, M., Owada, Y., Fukunaga, K., & Kondo, H. (2007) Distinct developmental expression of two isoforms of Ca2+/calmodulin-dependent protein kinase kinases and their involvement in hippocampal dendritic formation Neurosci. Lett., 423, 143–148.
28) Mizuno, K., Ris, L., Sanchez-Capelo, A., Godaux, E., & Giese, K.P. (2006) Ca2+/calmodulin kinase kinase α is dispensable for brain development but is required for distinct memories in male, though not in female, mice Mol. Cell. Biol., 26, 9094–9104.
29) Peters, M., Mizuno, K., Ris, L., Angelo, M., Godaux, E., & Giese, K.P. (2003) Loss of Ca2+/calmodulin kinase kinase β affects the formation of some, but not all, types of hippocampus-dependent long-term memory J. Neurosci., 23, 9752–9760.
30) Kimura, Y., Corcoran, E.E., Eto, K., Gengyo-Ando, K., Muramatsu, M.A., Kobayashi, R., Freedman, J.H., Mitani, S., Hagiwara, M., Means, A.R., et al. (2002) A CaMK cascade activates CRE-mediated transcription in neurons of Caenorhabditis elegans EMBO Rep., 3, 962–966.
31) Joseph, J.D. & Means, A.R. (2000) Identification and characterization of two Ca2+/CaM-dependent protein kinases required for normal nuclear division in Aspergillus nidulans J. Biol. Chem., 275, 38230–38238.
32) Hanyu, Y., Imai, K.K., Kawasaki, Y., Nakamura, T., Nakaseko, Y., Nagao, K., Kokubu, A., Ebe, M., Fujisawa, A., Hayashi, T., et al. (2009) Schizosaccharomyces pombe cell division cycle under limited glucose requires Ssp1 kinase, the putative CaMKK, and Sds23, a PP2A-related phosphatase inhibitor Genes Cells, 14, 539–554.
33) Valbuena, N. & Moreno, S. (2012) AMPK phosphorylation by Ssp1 is required for proper sexual differentiation in fission yeast J. Cell Sci., 125, 2655–2664.
34) Tokumitsu, H., Iwabu, M., Ishikawa, Y., & Kobayashi, R. (2001) Differential regulatory mechanism of Ca2+/calmodulin-dependent protein kinase kinase isoforms Biochemistry, 40, 13925–13932.
35) Tokumitsu, H., Takahashi, N., Eto, K., Yano, S., Soderling, T.R., & Muramatsu, M. (1999) Substrate recognition by Ca2+/calmodulin-dependent protein kinase kinase. Role of the arg-pro-rich insert domain J. Biol. Chem., 274, 15803–15810.
36) Tokumitsu, H., Muramatsu, M., Ikura, M., & Kobayashi, R. (2000) Regulatory mechanism of Ca2+/calmodulin-dependent protein kinase kinase J. Biol. Chem., 275, 20090–20095.
37) Osawa, M., Tokumitsu, H., Swindells, M.B., Kurihara, H., Orita, M., Shibanuma, T., Furuya, T., & Ikura, M. (1999) A novel target recognition revealed by calmodulin in complex with Ca2+-calmodulin-dependent kinase kinase Nat. Struct. Biol., 6, 819–824.
38) Kaitsuka, T., Li, S.T., Nakamura, K., Takao, K., Miyakawa, T., & Matsushita, M. (2011) Forebrain-specific constitutively active CaMKKα transgenic mice show deficits in hippocampus-dependent long-term memory Neurobiol. Learn. Mem., 96, 238–247.
39) Tokumitsu, H., Hatano, N., Fujimoto, T., Yurimoto, S., & Kobayashi, R. (2011) Generation of autonomous activity of Ca2+/calmodulin-dependent protein kinase kinase β by autophosphorylation Biochemistry, 50, 8193–8201.
40) Fujiwara, Y., Kawaguchi, Y., Fujimoto, T., Kanayama, N., Magari, M., & Tokumitsu, H. (2016) Differential AMP-activated protein kinase (AMPK) recognition mechanism of Ca2+/calmodulin-dependent protein kinase kinase isoforms J. Biol. Chem., 291, 13802–13808.
41) Wayman, G.A., Tokumitsu, H., & Soderling, T.R. (1997) Inhibitory cross-talk by cAMP kinase on the calmodulin-dependent protein kinase cascade J. Biol. Chem., 272, 16073–16076.
42) Matsushita, M. & Nairn, A.C. (1999) Inhibition of the Ca2+/calmodulin-dependent protein kinase I cascade by cAMP-dependent protein kinase J. Biol. Chem., 274, 10086–10093.
43) Davare, M.A., Saneyoshi, T., Guire, E.S., Nygaard, S.C., & Soderling, T.R. (2004) Inhibition of calcium/calmodulin-dependent protein kinase kinase by protein 14-3-3 J. Biol. Chem., 279, 52191–52199.
44) Ichimura, T., Taoka, M., Hozumi, Y., Goto, K., & Tokumitsu, H. (2008) 14-3-3 Proteins directly regulate Ca2+/calmodulin-dependent protein kinase kinase αthrough phosphorylation-dependent multisite binding FEBS Lett., 582, 661–665.
45) Nakanishi, A., Hatano, N., Fujiwara, Y., Sha’ri, A., Takabatake, S., Akano, H., Kanayama, N., Magari, M., Nozaki, N., & Tokumitsu, H. (2017) AMP-activated protein kinase-mediated feedback phosphorylation controls the Ca2+/calmodulin (CaM) dependence of Ca2+/CaM-dependent protein kinase kinase β J. Biol. Chem., 292, 19804–19813.
46) Green, M.F., Scott, J.W., Steel, R., Oakhill, J.S., Kemp, B.E., & Means, A.R. (2011) Ca2+/Calmodulin-dependent protein kinase kinase β is regulated by multisite phosphorylation J. Biol. Chem., 286, 28066–28079.
47) Tokumitsu, H., Inuzuka, H., Ishikawa, Y., Ikeda, M., Saji, I., & Kobayashi, R. (2002) STO-609, a specific inhibitor of the Ca2+/calmodulin-dependent protein kinase kinase J. Biol. Chem., 277, 15813–15818.
48) Bain, J., Plater, L., Elliott, M., Shpiro, N., Hastie, C.J., McLauchlan, H., Klevernic, I., Arthur, J.S., Alessi, D.R., & Cohen, P. (2007) The selectivity of protein kinase inhibitors:a further update Biochem. J., 408, 297–315.
49) Monteiro, P., Gilot, D., Langouet, S., & Fardel, O. (2008) Activation of the aryl hydrocarbon receptor by the calcium/calmodulin-dependent protein kinase kinase inhibitor 7-oxo-7H-benzimidazo[2,1-a]benz[de]isoquinoline-3-carboxylic acid (STO-609) Drug Metab. Dispos., 36, 2556–2563.
50) Tokumitsu, H., Inuzuka, H., Ishikawa, Y., & Kobayashi, R. (2003) A single amino acid difference between α and β Ca2+/calmodulin-dependent protein kinase kinase dictates sensitivity to the specific inhibitor, STO-609 J. Biol. Chem., 278, 10908–10913.
51) Kukimoto-Niino, M., Yoshikawa, S., Takagi, T., Ohsawa, N., Tomabechi, Y., Terada, T., Shirouzu, M., Suzuki, A., Lee, S., Yamauchi, T., et al. (2011) Crystal structure of the Ca2+/calmodulin-dependent protein kinase kinase in complex with the inhibitor STO-609 J. Biol. Chem., 286, 22570–22579.
52) Wayman, G.A., Kaech, S., Grant, W.F., Davare, M., Impey, S., Tokumitsu, H., Nozaki, N., Banker, G., & Soderling, T.R. (2004) Regulation of axonal extension and growth cone motility by calmodulin-dependent protein kinase I J. Neurosci., 24, 3786–3794.
53) Fujiwara, Y., Hiraoka, Y., Fujimoto, T., Kanayama, N., Magari, M., & Tokumitsu, H. (2015) Analysis of distinct roles of CaMKK isoforms using STO-609-resistant mutants in living cells Biochemistry, 54, 3969–3977.
54) Jensen, K.F., Ohmstede, C.A., Fisher, R.S., & Sahyoun, N. (1991) Nuclear and axonal localization of Ca2+/calmodulin-dependent protein kinase type Gr in rat cerebellar cortex Proc. Natl. Acad. Sci. USA, 88, 2850–2853.
55) Enslen, H., Sun, P., Brickey, D., Soderling, S.H., Klamo, E., & Soderling, T.R. (1994) Characterization of Ca2+/calmodulin-dependent protein kinase IV. Role in transcriptional regulation J. Biol. Chem., 269, 15520–15527.
56) Bito, H., Deisseroth, K., & Tsien, R.W. (1996) CREB phosphorylation and dephosphorylation:a Ca2+- and stimulus duration-dependent switch for hippocampal gene expression Cell, 87, 1203–1214.
57) Miranti, C.K., Ginty, D.D., Huang, G., Chatila, T., & Greenberg, M.E. (1995) Calcium activates serum response factor-dependent transcription by a Ras- and Elk-1-independent mechanism that involves a Ca2+/calmodulin-dependent kinase Mol. Cell. Biol., 15, 3672–3684.
58) Kotera, I., Sekimoto, T., Miyamoto, Y., Saiwaki, T., Nagoshi, E., Sakagami, H., Kondo, H., & Yoneda, Y. (2005) Importin α transports CaMKIV to the nucleus without utilizing importin β EMBO J., 24, 942–951.
59) Colbran, R.J. (1992) Regulation and role of brain calcium/calmodulin-dependent protein kinase II Neurochem. Int., 21, 469–497.
60) Fukunaga, K., Rich, D.P., & Soderling, T.R. (1989) Generation of the Ca2+-independent form of Ca2+/calmodulin-dependent protein kinase II in cerebellar granule cells J. Biol. Chem., 264, 21830–21836.
61) Tokumitsu, H., Hatano, N., Inuzuka, H., Yokokura, S., Nozaki, N., & Kobayashi, R. (2004) Mechanism of the generation of autonomous activity of Ca2+/calmodulin-dependent protein kinase IV J. Biol. Chem., 279, 40296–40302.
62) Takata, T., Ihara, H., Hatano, N., Tsuchiya, Y., Akaike, T., & Watanabe, Y. (2017) Reactive sulfur species inactivate Ca2+/calmodulin-dependent protein kinase IV via S-polysulfidation of its active-site cysteine residue Biochem. J., 474, 2547–2562.
63) Silva, A.J., Kogan, J.H., Frankland, P.W., & Kida, S. (1998) CREB and memory Annu. Rev. Neurosci., 21, 127–148.
64) Ho, N., Liauw, J.A., Blaeser, F., Wei, F., Hanissian, S., Muglia, L.M., Wozniak, D.F., Nardi, A., Arvin, K.L., Holtzman, D.M., et al. (2000) Impaired synaptic plasticity and cAMP response element-binding protein activation in Ca2+/calmodulin-dependent protein kinase type IV/Gr-deficient mice J. Neurosci., 20, 6459–6472.
65) Takao, K., Tanda, K., Nakamura, K., Kasahara, J., Nakao, K., Katsuki, M., Nakanishi, K., Yamasaki, N., Toyama, K., Adachi, M., et al. (2010) Comprehensive behavioral analysis of calcium/calmodulin-dependent protein kinase IV knockout mice PLoS One, 5, e9460.
66) Park, I.K. & Soderling, T.R. (1995) Activation of Ca2+/calmodulin-dependent protein kinase (CaM-kinase) IV by CaM-kinase kinase in Jurkat T lymphocytes J. Biol. Chem., 270, 30464–30469.
67) Gringhuis, S.I., de Leij, L.F., Wayman, G.A., Tokumitsu, H., & Vellenga, E. (1997) The Ca2+/calmodulin-dependent kinase type IV is involved in the CD5-mediated signaling pathway in human T lymphocytes J. Biol. Chem., 272, 31809–31820.
68) Sato, K., Suematsu, A., Nakashima, T., Takemoto-Kimura, S., Aoki, K., Morishita, Y., Asahara, H., Ohya, K., Yamaguchi, A., Takai, T., et al. (2006) Regulation of osteoclast differentiation and function by the CaMK-CREB pathway Nat. Med., 12, 1410–1416.
69) Ban, N., Yamada, Y., Someya, Y., Ihara, Y., Adachi, T., Kubota, A., Watanabe, R., Kuroe, A., Inada, A., Miyawaki, K., et al. (2000) Activating transcription factor-2 is a positive regulator in CaM kinase IV-induced human insulin gene expression Diabetes, 49, 1142–1148.
70) Yu, X., Murao, K., Sayo, Y., Imachi, H., Cao, W.M., Ohtsuka, S., Niimi, M., Tokumitsu, H., Inuzuka, H., Wong, N.C., et al. (2004) The role of calcium/calmodulin-dependent protein kinase cascade in glucose upregulation of insulin gene expression Diabetes, 53, 1475–1481.
71) Murao, K., Imachi, H., Cao, W.M., Yu, X., Tokumitsu, H., Inuzuka, H., Wong, N.C., Shupnik, M.A., Kobayashi, R., & Ishida, T. (2004) Role of calcium-calmodulin-dependent protein kinase cascade in thyrotropin (TSH)-releasing hormone induction of TSH and prolactin gene expression Endocrinology, 145, 4846–4852.
72) Eto, K., Takahashi, N., Kimura, Y., Masuho, Y., Arai, K., Muramatsu, M.A., & Tokumitsu, H. (1999) Ca2+/calmodulin-dependent protein kinase cascade in Caenorhabditis elegans. Implication in transcriptional activation J. Biol. Chem., 274, 22556–22562.
73) Schild, L.C., Zbinden, L., Bell, H.W., Yu, Y.V., Sengupta, P., Goodman, M.B., & Glauser, D.A. (2014) The balance between cytoplasmic and nuclear CaM kinase-1 signaling controls the operating range of noxious heat avoidance Neuron, 84, 983–996.
74) Takemoto-Kimura, S., Suzuki, K., Horigane, S.I., Kamijo, S., Inoue, M., Sakamoto, M., Fujii, H., & Bito, H. (2017) Calmodulin kinases:essential regulators in health and disease J. Neurochem., 141, 808–818.
75) Takano, T., Wu, M., Nakamuta, S., Naoki, H., Ishizawa, N., Namba, T., Watanabe, T., Xu, C., Hamaguchi, T., Yura, Y., et al. (2017) Discovery of long-range inhibitory signaling to ensure single axon formation Nat. Commun., 8, 33.
76) Saneyoshi, T., Wayman, G., Fortin, D., Davare, M., Hoshi, N., Nozaki, N., Natsume, T., & Soderling, T.R. (2008) Activity-dependent synaptogenesis:regulation by a CaM-kinase kinase/CaM-kinase I/βPIX signaling complex Neuron, 57, 94–107.
77) Fortin, D.A., Davare, M.A., Srivastava, T., Brady, J.D., Nygaard, S., Derkach, V.A., & Soderling, T.R. (2010) Long-term potentiation-dependent spine enlargement requires synaptic Ca2+-permeable AMPA receptors recruited by CaM-kinase I J. Neurosci., 30, 11565–11575.
78) Ageta-Ishihara, N., Takemoto-Kimura, S., Nonaka, M., Adachi-Morishima, A., Suzuki, K., Kamijo, S., Fujii, H., Mano, T., Blaeser, F., Chatila, T.A., et al. (2009) Control of cortical axon elongation by a GABA-driven Ca2+/calmodulin-dependent protein kinase cascade J. Neurosci., 29, 13720–13729.
79) Nakamuta, S., Funahashi, Y., Namba, T., Arimura, N., Picciotto, M.R., Tokumitsu, H., Soderling, T.R., Sakakibara, A., Miyata, T., Kamiguchi, H., et al. (2011) Local application of neurotrophins specifies axons through inositol 1,4,5-trisphosphate, calcium, and Ca2+/calmodulin-dependent protein kinases Sci. Signal., 4, ra76.
80) Momcilovic, M., Hong, S.P., & Carlson, M. (2006) Mammalian TAK1 activates Snf1 protein kinase in yeast and phosphorylates AMP-activated protein kinase in vitro J. Biol. Chem., 281, 25336–25343.
81) Lizcano, J.M., Goransson, O., Toth, R., Deak, M., Morrice, N.A., Boudeau, J., Hawley, S.A., Udd, L., Makela, T.P., Hardie, D.G., et al. (2004) LKB1 is a master kinase that activates 13 kinases of the AMPK subfamily, including MARK/PAR-1 EMBO J., 23, 833–843.
82) Anderson, K.A., Ribar, T.J., Lin, F., Noeldner, P.K., Green, M.F., Muehlbauer, M.J., Witters, L.A., Kemp, B.E., & Means, A.R. (2008) Hypothalamic CaMKK2 contributes to the regulation of energy balance Cell Metab., 7, 377–388.
83) Ghislat, G., Patron, M., Rizzuto, R., & Knecht, E. (2012) Withdrawal of essential amino acids increases autophagy by a pathway involving Ca2+/calmodulin-dependent kinase kinase-β (CaMKK-β) J. Biol. Chem., 287, 38625–38636.
84) Yamauchi, M., Kambe, F., Cao, X., Lu, X., Kozaki, Y., Oiso, Y., & Seo, H. (2008) Thyroid hormone activates adenosine 5′-monophosphate-activated protein kinase via intracellular calcium mobilization and activation of calcium/calmodulin-dependent protein kinase kinase-β Mol. Endocrinol., 22, 893–903.
85) Lin, F., Marcelo, K.L., Rajapakshe, K., Coarfa, C., Dean, A., Wilganowski, N., Robinson, H., Sevick, E., Bissig, K.D., Goldie, L.C., et al. (2015) The CaMKK2/CaMKIV relay is an essential regulator of hepatic cancer Hepatology, 62, 505–520.
86) Massie, C.E., Lynch, A., Ramos-Montoya, A., Boren, J., Stark, R., Fazli, L., Warren, A., Scott, H., Madhu, B., Sharma, N., et al. (2011) The androgen receptor fuels prostate cancer by regulating central metabolism and biosynthesis EMBO J., 30, 2719–2733.
87) Jin, L., Chun, J., Pan, C., Kumar, A., Zhang, G., Ha, Y., Li, D., Alesi, G.N., Kang, Y., Zhou, L., et al. (2018) The PLAG1-GDH1 axis promotes anoikis resistance and tumor metastasis through CamKK2-AMPK signaling in LKB1-deficient lung cancer Mol. Cell, 69, 87–99.
88) York, B., Li, F., Lin, F., Marcelo, K.L., Mao, J., Dean, A., Gonzales, N., Gooden, D., Maity, S., Coarfa, C., et al. (2017) Pharmacological inhibition of CaMKK2 with the selective antagonist STO-609 regresses NAFLD Sci. Rep., 7, 11793.

 :リン酸化.
:リン酸化.