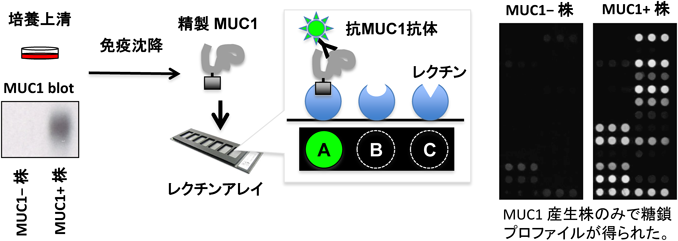
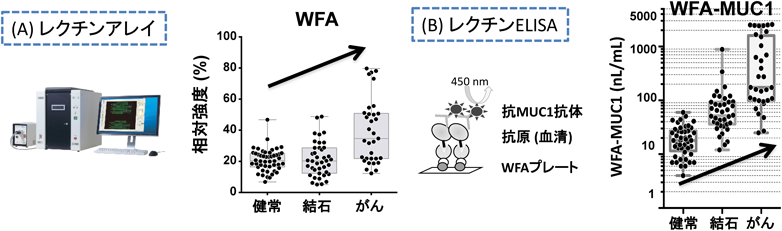
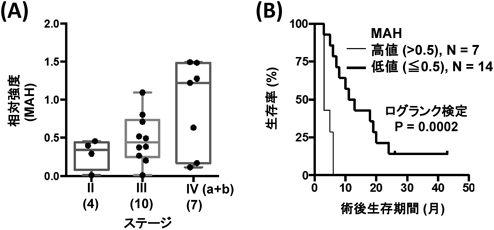
糖鎖プロファイリングによる疾患特異的マーカーの開発Development of a disease-specific glycol-biomarker with glycan profiling
慶應義塾大学医学部医化学教室Department of biochemistry, Keio University School of Medicine ◇ 〒160–8582 東京都新宿区信濃町35 ◇ 35 Sinanomachi, Shinjuku-ku, Tokyo 160–8582, Japan