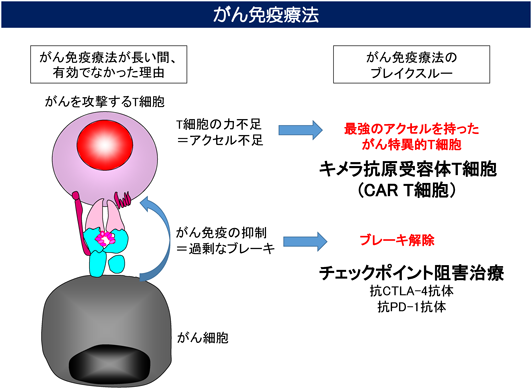
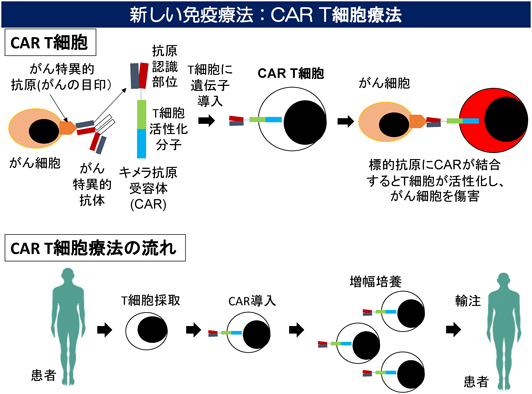
がんに対するキメラ抗原受容体発現T細胞療法Chimeric antigen receptor T cell therapy against cancer
大阪大学大学院医学系研究科癌幹細胞制御学Department of Cancer Stem Cell Biology, Osaka University Graduate School of Medicine ◇ 〒565–0871 大阪府吹田市山田丘1–7 ◇ 1–7 Yamadaoka, Suita, Osaka 565–0871, Japan