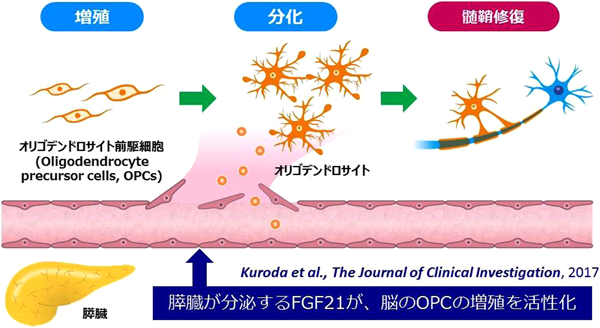
中枢神経系の修復における多臓器連関の意義Systemic mille regulates central nervous system regeneration
1 大阪大学大学院医学系研究科分子神経科学Department of Molecular Neuroscience, Graduate School of Medicine, Osaka University ◇ 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka
2 国立精神・神経医療研究センター神経研究所Department of Molecular Pharmacology, National Institute of Neuroscience, N.C.N.P. ◇ 東京都小平市小川東町4–1–1 ◇ 4–1–1 Ogawa-Higashi, Kodaira, Tokyo