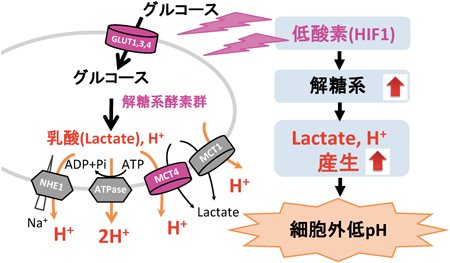
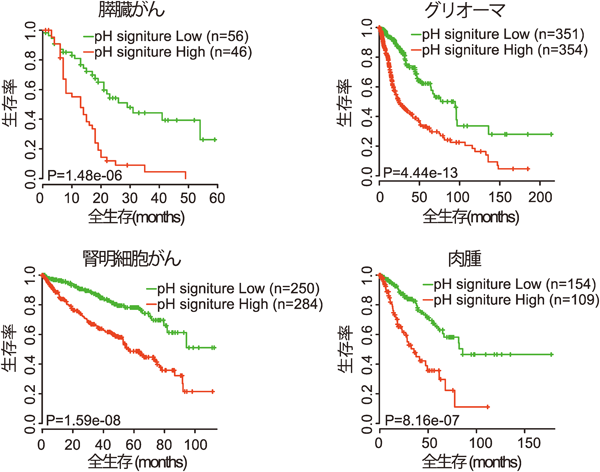
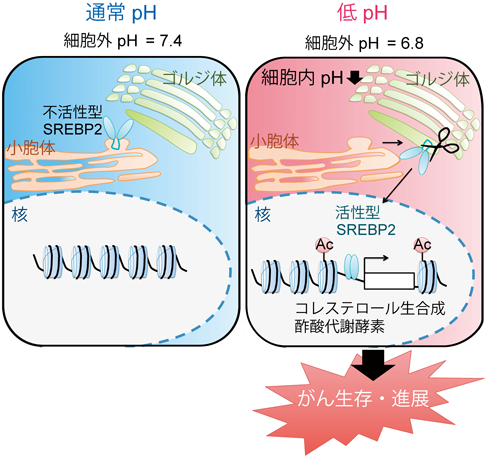
酸性環境における腫瘍の悪性化機構Acidic tumor microenvironment promotes tumor progression
1 協和発酵キリン株式会社Innovative Technology Laboratories, Kyowa Hakko Kirin, Co., Ltd. ◇ 東京都町田市旭町3–6–6 ◇ 3–6–6 Asahi-machi, Machida-shi, Tokyo
2 東京大学先端科学技術センターニュートリオミクス・腫瘍学分野Division of Integrative Nutriomics and Oncology, RCAST, The University of Tokyo ◇ 東京都目黒区駒場4–6–1 ◇ 4–6–1 Komaba, Meguro-ku, Tokyo