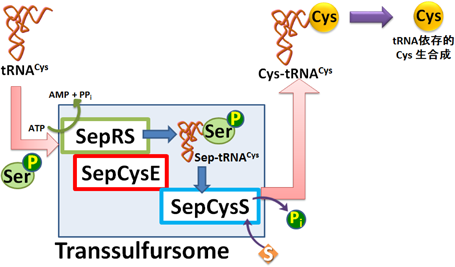
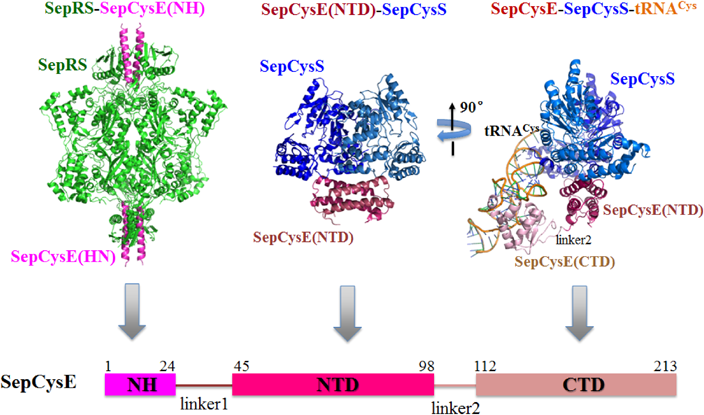
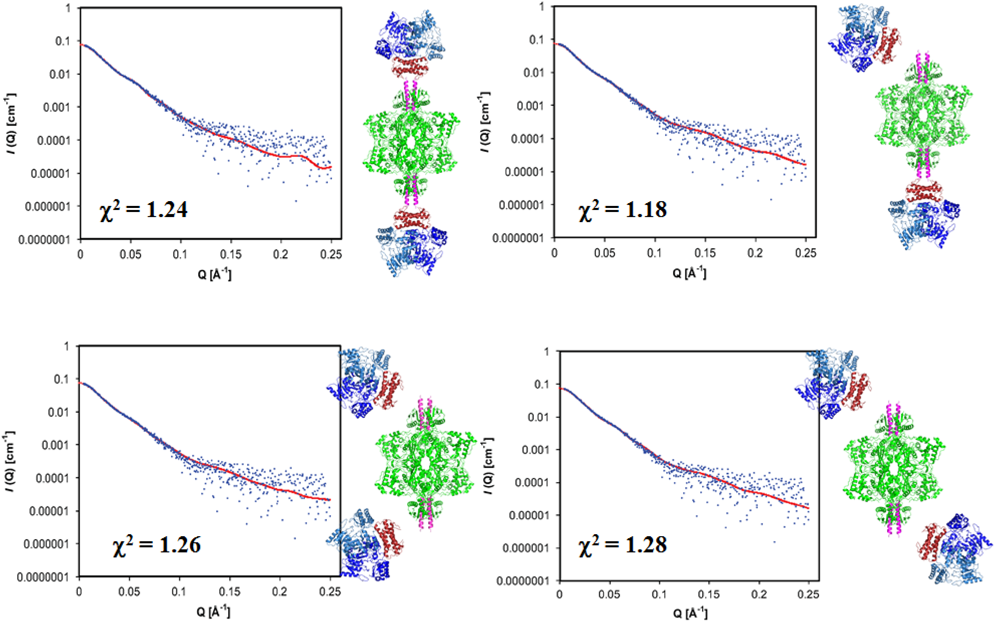
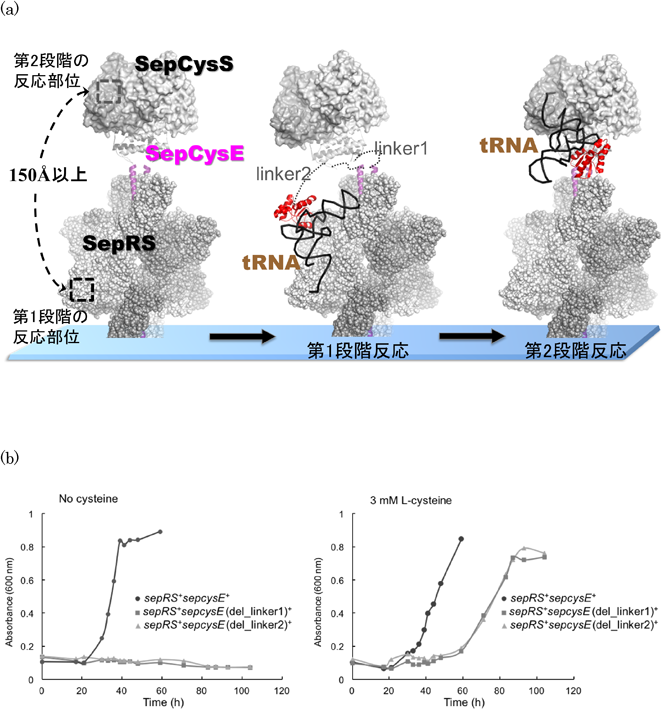
tRNA依存的アミノ酸システインの生合成複合体の分子機構Molecular basis of synthase complex for tRNA-dependent amino-acid cysteine biosynthesis
北海道大学大学院先端生命科学研究院Faculty of Advanced Life Sciences, Hokkaido University ◇ 〒060–0810 札幌市北区北10条西8丁目 ◇ Kita-10 Nishi-8, Sapporo 060–0810, Japan