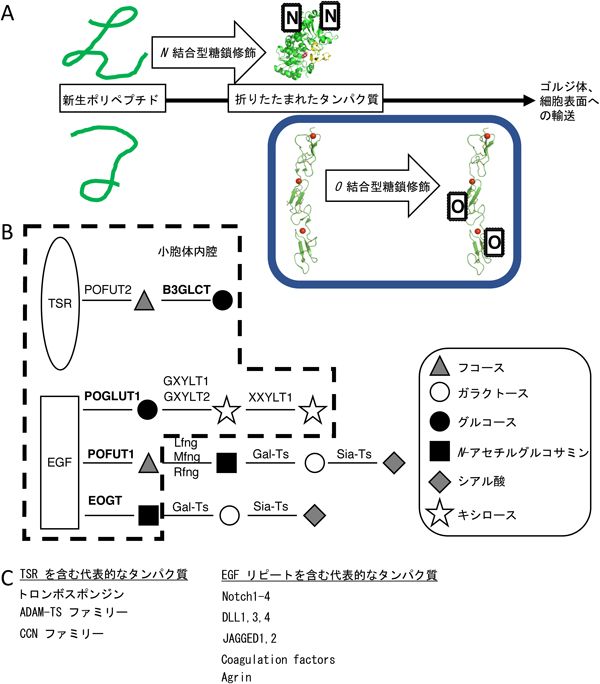
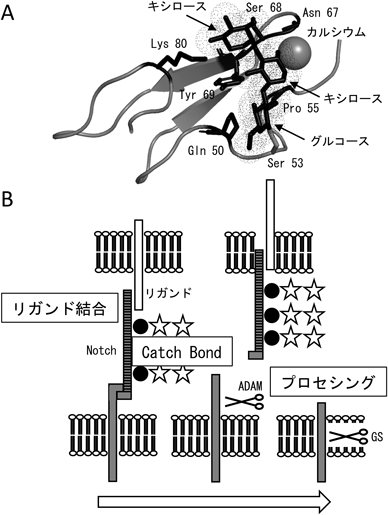
O-グルコース糖鎖修飾によるタンパク質の安定性の制御とその生物化学的意義Biochemical significance of regulation of protein stability by O-glucose glycans
名古屋大学大学院医学系研究科機能分子制御学Nagoya University School of Medicine, Department of Molecular Biochemistry ◇ 〒466–8550 名古屋市昭和区鶴舞町65 ◇ 65 Tsurumai, Showa, Nagoya 466–8550, Japan