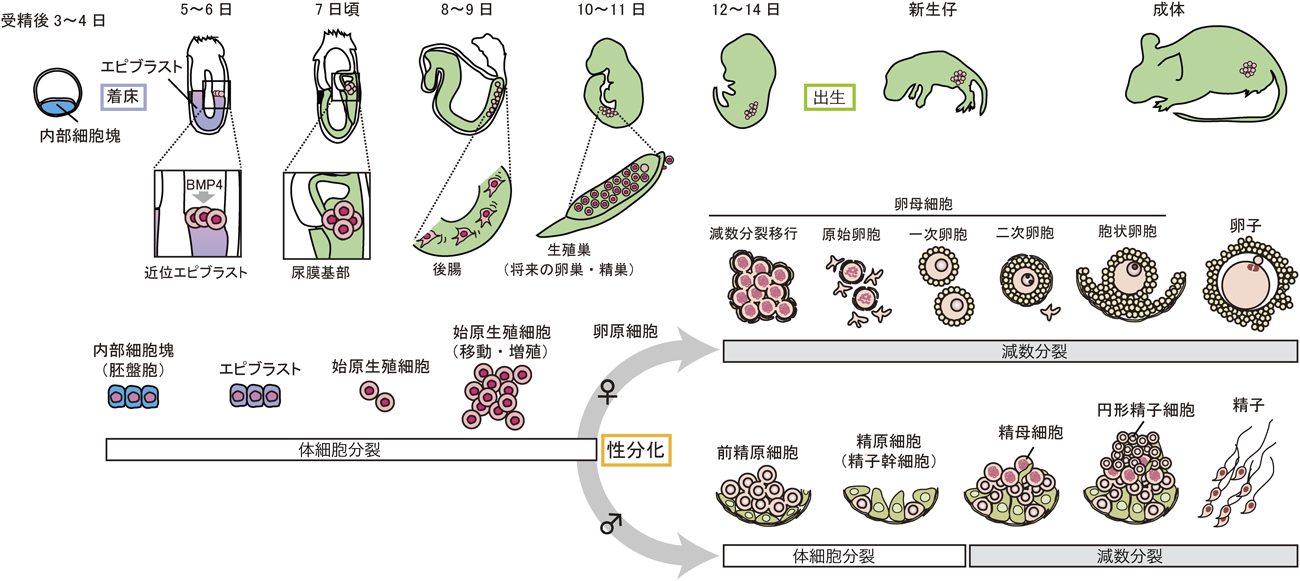
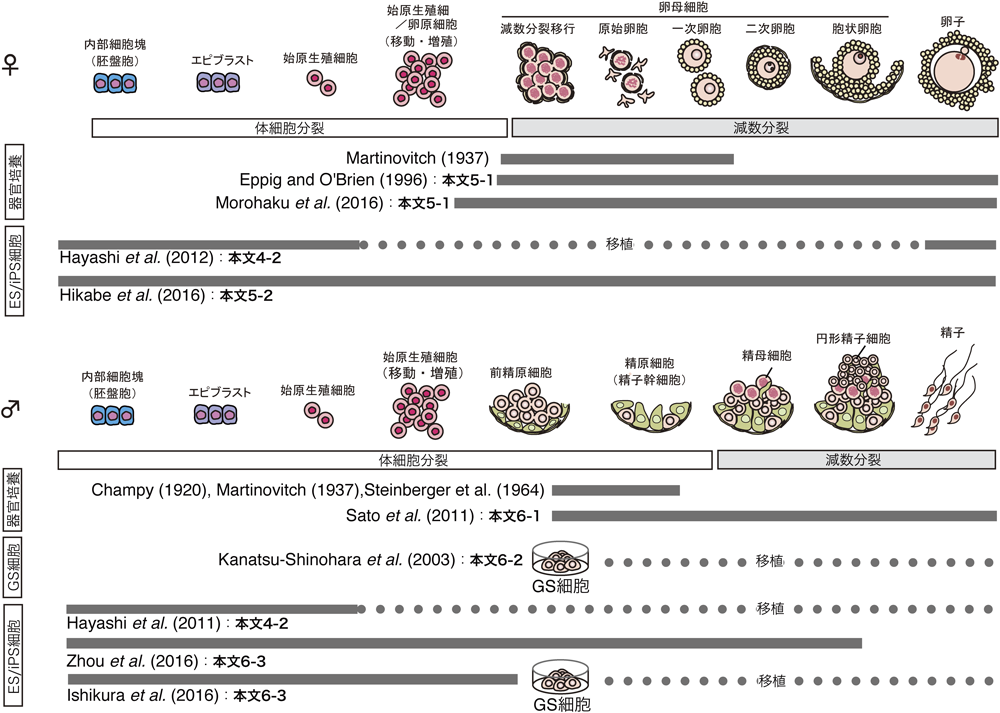
生殖細胞を体外培養で作る—in vitro gametogenesis—Current advance of in vitro gametogenesis
九州大学大学院医学研究院ヒトゲノム幹細胞医学分野Department of Stem Cell Biology of Medicine, Faculty of Medical Sciences, Kyushu University ◇ 〒812–8582 福岡市東区馬出3–1–1 ◇ Maidashi 3–1–1, Higashi-ku, Fukuoka 812–8582, Japan