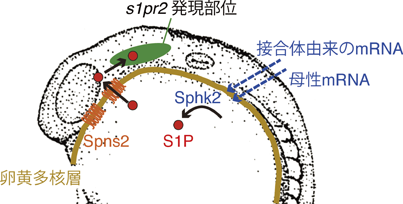
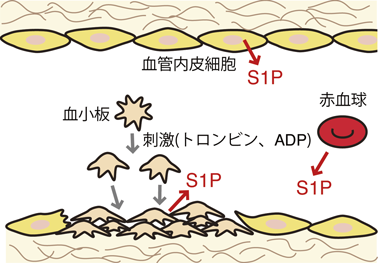
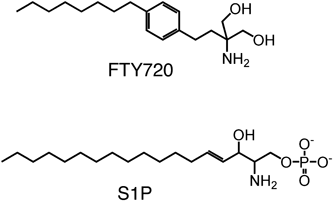
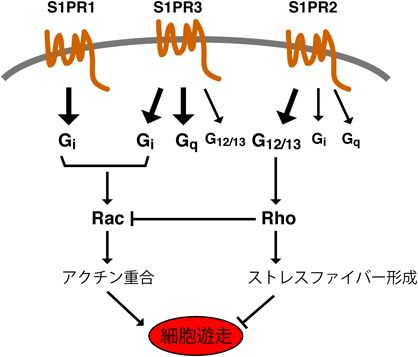
スフィンゴシン1-リン酸(S1P)輸送体であるSpns2の分子機能Molecular function of a sphingosine 1-phosphate (S1P) transporter, Spns2
1 Harvard Medical School, Boston Children’s HospitalHarvard Medical School, Boston Children’s Hospital ◇ 300 Longwood Avenue, Boston, MA 02115, USA ◇ 300 Longwood Avenue, Boston, MA 02115, USA
2 山梨大学大学院総合研究部医学教育センター発生生物学University of Yamanashi ◇ 山梨県中央市下河東1110 ◇ Shimokato 1110, Chuo, Yamanashi, Japan