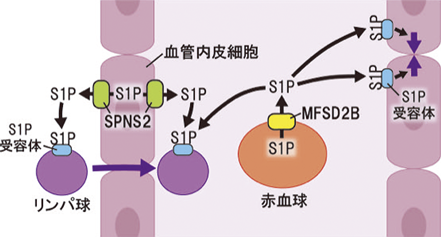
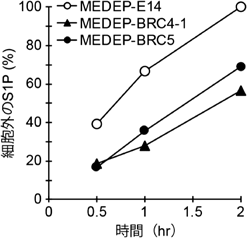
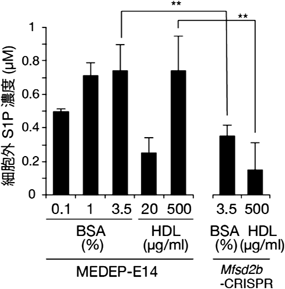
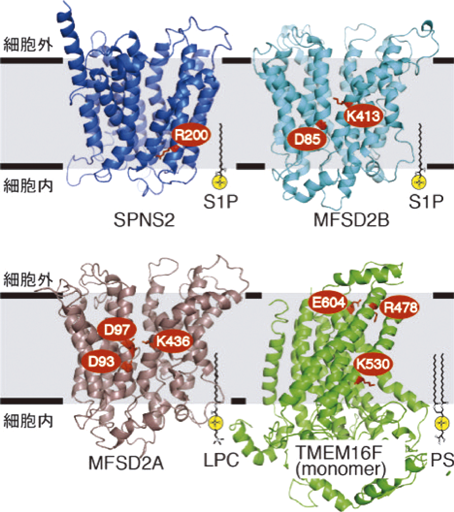
新たに同定された赤血球のS1P輸送体MFSD2BIdentification of a novel S1P transporter in erythrocytes
1 摂南大学薬学部生命融合化学分野Department of Biochemistry, Faculty of Pharmaceutical Sciences, Setsunan University ◇ 〒573–0101 大阪府枚方市長尾峠町45–1 ◇ 45–1 Nagaotoge-cho, Hirakata, Osaka 573–0101, Japan
2 大阪大学産業科学研究所生体分子制御科学研究分野Department of Biomolecular Science and Regulation, Osaka University ◇ 〒567–0047 大阪府茨木市美穂ヶ丘8–1 ◇ 8–1 Mihogaoka, Ibaraki, Osaka 567–0047, Japan
3 大阪大学大学院薬学研究科細胞生物学分野Faculty of Pharmaceutical Science, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘1–6 ◇ 1–6 Yamadaoka, Suita, Osaka 565–0871, Japan