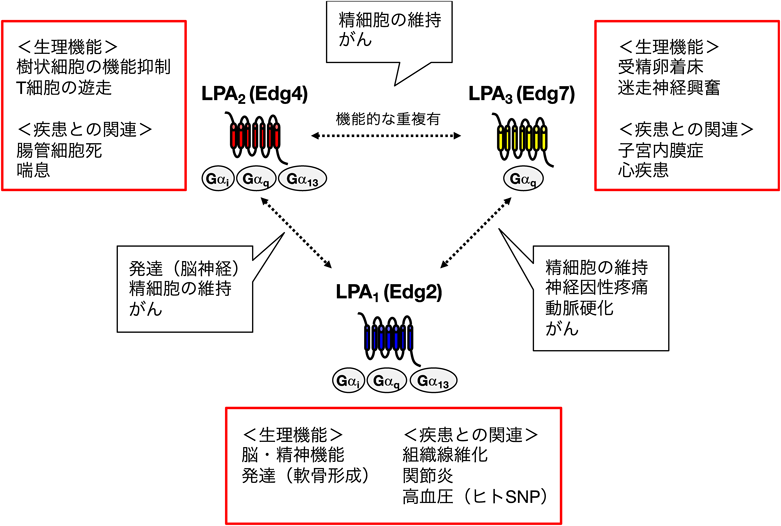
Edg型LPA受容体の構造と機能Structure and biological function of Edg-type LPA receptors
東北大学大学院薬学研究科分子細胞生化学Department of Molecular and Cellular Biochemistry, Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 ◇ 6–3 Aoba, Aramaki, Aoba-ku, Sendai, Miyagi 980–8578, Japan