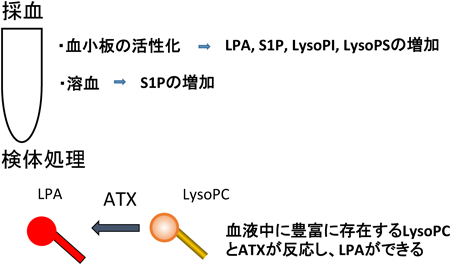
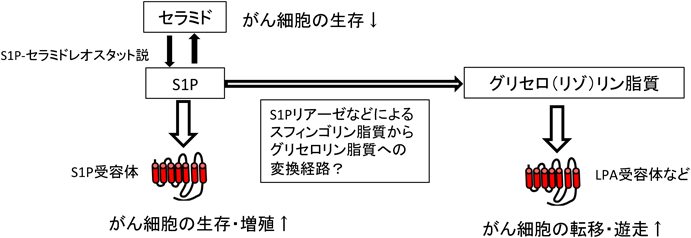
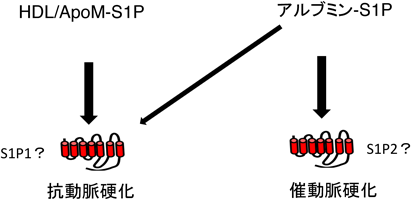
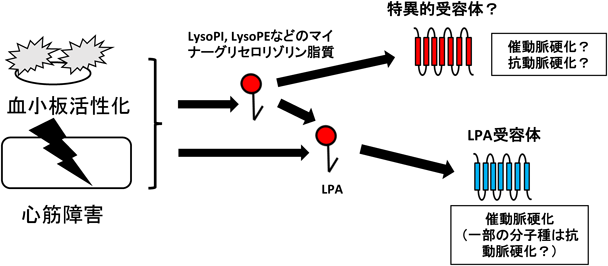
ヒト疾患におけるリゾリン脂質メディエーターInvolvement of lysophospholipid mediator in the pathogenesis of human diseases
東京大学大学院医学系研究科病態診断医学講座Department of Clinical Laboratory Medicine, Graduate School of Medicine, The University of Tokyo ◇ 〒113–8655 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–8655, Japan