糖鎖は核酸やタンパク質,脂質と並ぶ主要な生体分子であり,さまざまな様式で生体内にあまねく分布している.タンパク質の糖鎖による修飾は最も一般的な翻訳後・共翻訳修飾の一つであり,真核生物の全タンパク質の半数以上が糖鎖修飾を受けていると見積もられている.タンパク質・脂質上の糖鎖は多様な組成・構造を持ち,さまざまな生理機能に直接的あるいは間接的に関与する.糖鎖に関連する遺伝子の異常によって,脳や神経,筋肉などに重篤な先天性疾患が引き起こされることがわかり,その報告数は次世代シーケンシングの普及もあり着実に増えている1).糖鎖が情報分子(sugar code)として働くときの読み取り装置となるのが糖鎖結合タンパク質,“レクチン”である.レクチンは多様な糖鎖が混在している中から特定の糖鎖構造を識別して結合する.したがって糖鎖とレクチン間の相互作用およびその後の情報伝達機構を調べることは,糖鎖の生理機能を理解する上で必須である.
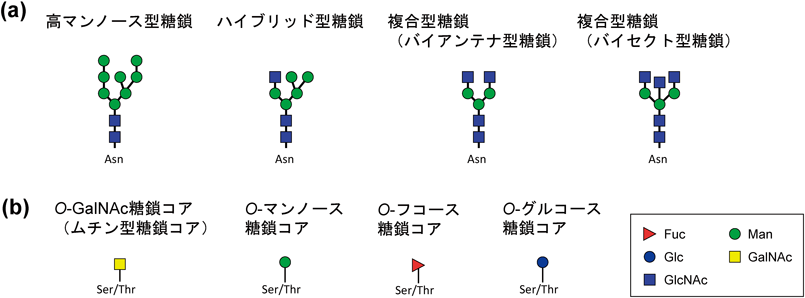
タンパク質の糖鎖修飾は大きくN結合型糖鎖とO結合型糖鎖の2種類に大別されてきた.N結合型糖鎖はコンセンサス配列(Asn-X-Ser/Thr, Xはプロリン以外)中のアスパラギン残基に翻訳と同時に,あるいは翻訳後に小胞体で付加され,O結合型糖鎖は特定のコンセンサス配列を持たず,セリンやトレオニン残基に翻訳後にゴルジ体で付加される(図1a).
N結合型糖鎖修飾は,リボソームから翻訳された新生ポリペプチド鎖がトランスロコンを通して小胞体内腔に入り込む段階で,オリゴ糖転移酵素(OST)複合体によって糖鎖が付加される.最近クライオ電子顕微鏡により酵母OST複合体の立体構造が提示されたことも記憶に新しい2, 3).OST複合体はドリコールリン脂質上の高マンノース型糖鎖をひとまとめに(en bloc)アスパラギン残基に付加する.高マンノース型糖鎖を持つ新生糖タンパク質はその後,ゴルジ体へと輸送される過程でグルコシダーゼ,マンノシダーゼなどの糖加水分解酵素によって刈り込みを受けたのちN-アセチルグルコサミン(GlcNAc)やガラクトース(Gal),シアル酸(Sia),フコース(Fuc)などの糖残基が個々の糖転移酵素によって付加される.こうした過程を経てでき上がった糖鎖は複合型糖鎖と呼ばれ,2本から5本の分岐構造を持っている.分岐鎖にはGalとGlcNAcが結合したラクトサミン(Galβ1-4GlcNAc)構造がみられ,ガレクチンなどの標的となっている.興味深いことに複合型糖鎖の分岐構造は共通の糖鎖構造を持ちながら,時に別々の生理機能に関与することが知られている.たとえば複合型糖鎖の一種であるバイアンテナ糖鎖には1-3アームと1-6アームの二つの枝があり,この2本の枝は同じ糖鎖構造を持つことがある.しかし枝依存的に分岐構造を認識するレクチンも存在する4, 5).こうした糖鎖の分岐構造と機能の関係を解き明かす研究は今まさに始まった段階であり,複雑な糖鎖構造が持つ暗号を解読することにつながると筆者らは考えている.
O結合型糖鎖修飾はセリンまたはトレオニン残基にN-アセチルガラクトサミン(GalNAc)が結合したもので,ムチンやIgA, IgGなど広範に本修飾を見いだすことができる.しかし最近の糖鎖生物学の進展と分析技術の進歩によって異なったタイプのO結合型糖鎖,すなわちO-マンノース,O-グルコース,O-フコースなどの糖鎖の存在も明らかになってきた(図1b).そのため古典的なO結合型糖鎖(ムチン型糖鎖)はこれらの糖鎖と区別するためにO-GalNAc糖鎖と呼ぶように提唱されている.O-GalNAc糖鎖と比べてO-マンノース,O-グルコース,O-フコース糖鎖は通常生体内で発現が限られており,それぞれの糖鎖合成を担う糖転移酵素が基質タンパク質に対して高い選択性を発揮しているようである.こうした非典型的な糖鎖がタンパク質との相互作用を通じて生み出す生理機能の発現メカニズムの一端は構造生物学研究からも解明されつつある.一方でO-GalNAc糖鎖はその広範な分布から特異的なシグナルとして働くことはあまり想定されてこなかったが,最近の機能解析や構造生物学研究からそのシグナルとしての重要性も明らかになってきた.
糖鎖を認識するタンパク質を一般にレクチンと呼ぶが,細胞内腔および細胞外で働くタンパク質には糖鎖と結合するドメイン(レクチンドメイン)を持つものも数多く存在する.こうしたレクチンまたはレクチンドメインは一部を除きいずれも分子量が約15,000~20,000程度と比較的小さいものが多く,糖鎖との接触面積も比較的限られている.それにもかかわらず,複雑で多様な化学構造を持つ糖鎖に対して特異性や親和性を発揮している仕組みは大変興味深く,糖鎖構造生物学研究を行う一つの動機となっている.
レクチンはいくつかのファミリーに分類されるが,それぞれ特徴的なフォールドを有しており,糖鎖に対する特異性が異なっている.ファミリーごとに中心となる単糖もしくは二糖の認識を担うアミノ酸残基は高度に保存されており,糖鎖に対する特異性の違いはその周辺のアミノ酸によって決定されている場合が多い.本節では代表的なレクチンのファミリーであるシグレック,ガレクチン,C型レクチンを取り上げて概説する.
1)シグレック
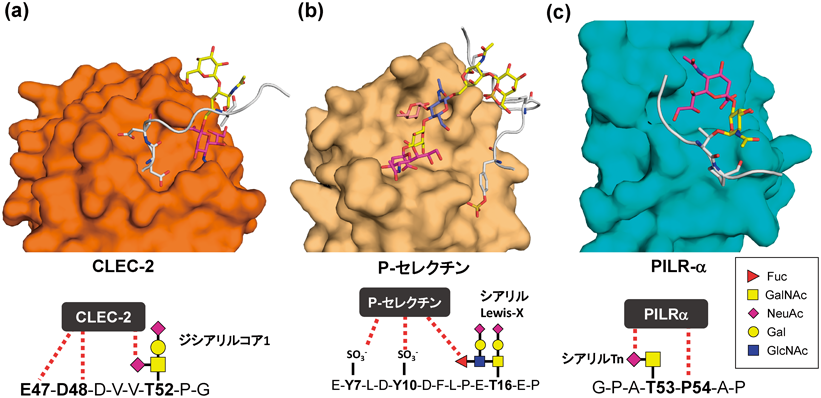
シグレックはシアル酸を認識するレクチンで,大きなファミリーを形成している.シグレックは細胞表面に発現し,細胞間接着や自然免疫および獲得免疫に関与している.シグレックはI型膜貫通タンパク質であり,細胞外のモジュラー構造のN末端にレクチン活性を有するV型イムノグロブリンフォールド(Ig-Vドメイン)を持つ.Ig-Vドメイン以外に,糖鎖結合活性のないC型イムノグロブリンフォールドが複数あり,膜貫通領域を経て細胞内のシグナル伝達に必要なモチーフへとつながる.レクチン活性を有するIg-Vドメインはファミリー内の構造類似性が高く,シアル酸の認識モチーフも高度に保存されている(図2a左).シグレック2はCD22とも呼ばれ,B細胞表面に発現する抑制性の免疫受容体であり,液性免疫の恒常性の維持に重要な役割を果たしている.CD22は細胞外にIg-Vドメイン(d1ドメイン)と六つのC型イムノグロブリンフォールド(d2~d7ドメイン)を持つ.シアル酸はN結合型糖鎖およびO結合型糖鎖の非還元末端にみられる糖で,α2-3, α2-6, α2-8結合などさまざまな結合様式が知られているが,シグレック2はα2-6結合したシアル酸に特異的に結合する.ヒトシグレック2の細胞外ドメイン(d1~d3)とα2-6シアリルラクトース(NeuAcα2-6Galβ1-4Glc)との複合体の結晶構造によると,シアル酸結合部位から少し離れた場所に位置するチロシン残基(Y64)がα2-6結合したシアル酸残基以外を排除するフィルターとして働いており,結果としてシグレック2はα2-6結合シアル酸を選択している6)(図2a右).
2)ガレクチン
ガレクチンはガラクトース残基を特異的に認識する可溶性のレクチンであり,N結合型糖鎖,O結合型糖鎖,糖脂質など幅広い糖鎖をリガンドとする.ガレクチンの機能は細胞間接着,細胞–マトリックス接着,細胞表面受容体のシグナル効率の調節などが知られているが不明な点も多い.ガレクチンのレクチンドメインは共通の11~12本のβストランドからなるβサンドイッチ構造をとっている.分子表面の凹面側(concave side)にある2本のβストランド表面のアミノ酸残基がガラクトースとの相互作用に関わっている(図2b左).そのアミノ酸残基はガレクチン間で高度に保存されているが,その周囲,特にガラクトースの非還元末端側に位置するアミノ酸が各ガレクチンの個性を生み出す元になっている.たとえば,ヒトガレクチン9はフォルスマン抗原糖鎖(GalNAcα1-3GalNAcβ1-3Galα1-4Galβ1-4Glc)と非常に強固に結合する.ヒトガレクチン9とフォルスマン抗原糖鎖の複合体の結晶構造を調べてみると,予想に反して非還元末端から二番目のGalNAc残基が,通常ガラクトース残基の結合するポケットに収まり,両隣を含む三糖(GalNAcα1-3GalNAcβ1-3Gal)を厳密に認識していた.その特異的な相互作用を決定しているのはガラクトース結合部位の近傍に位置するアミノ酸残基(A46とN137)であった7)(図2b右).
糖鎖結合部位周辺の形状によってもガレクチンと直鎖状糖鎖との結合様式が変化する.ガレクチンはN結合型糖鎖の分岐構造などにみられるラクトサミン(Galβ1-4GlcNAc),特にラクトサミンがβ1-3結合で連結した直鎖状糖鎖,ポリラクトサミン(-3Galβ1-4GlcNAcβ1-)nと高親和性で結合する.しかしガレクチンのファミリーにはポリラクトサミンの鎖長に応じて親和性が上昇するものと変化しないタイプが存在する.たとえばヒトガレクチン9は鎖長依存的に親和性が上昇するが,ヒトガレクチン1は鎖長が変化しても親和性は変化しない8).我々はこれを一般化して,レクチンの立体構造から糖鎖との相互作用様式をエクソ型とエンド型の2種類に分類した9).ガレクチン1のようなエクソ型ガレクチンは直鎖状多糖の末端にしか結合できないため,鎖長依存的な親和性の上昇がない.対してガレクチン3, 9のようなエンド型ガレクチンは,直鎖状多糖の末端のみならず内部のラクトサミンユニットにも結合しうる.エンド型は多糖上の結合サイト数が増え,さらに解離後の再結合が促進されるために見かけの親和性が上昇すると説明できる.
3)C型レクチン
C型レクチンはCa2+依存的に糖鎖と結合するレクチンであり,巨大なファミリーを形成している10).C型レクチンドメインは可溶性タンパク質,膜貫通タンパク質の両方にみられ,後生動物などに広く分布している.その生理機能は血液凝固系や免疫系など多岐にわたる.詳細は後述するが,免疫系で働くC型レクチンの多くは,膜貫通受容体として樹状細胞などに発現し,ウイルスや病原菌などの外来異物由来の糖鎖を認識するパターン認識受容体として働いているものが多い.C型レクチンドメインは共通のα/βフォールドを有し,βシート表面に結合したCa2+に糖鎖の二つの水酸基が配位することでレクチンに結合する(図2c左).C型レクチンのCa2+結合モチーフは主に2種類存在し,EPN(Glu-Pro-Asn)モチーフとQPD(Gln-Pro-Asp)モチーフが知られている.EPNモチーフならマンノース,QPDモチーフならガラクトースと結合する11).おおむねC型レクチンはこのルールに従うが,例外も存在する.C型レクチン受容体の一つであるLangerinはランゲルハンス細胞に発現し,非自己の糖鎖を認識して細胞内に取り込みBirbeck granuleと呼ばれる細胞内小器官で分解する.興味深いことにLangerinはEPNモチーフを有するにもかかわらず6位が硫酸化されたガラクトースと結合する.この場合,6位の硫酸基とLangerinのリシン残基との静電相互作用による安定化がガラクトースの受け入れを可能にしていると思われる12, 13).
C型レクチン受容体であるマウスDCIR2は,樹状細胞に発現しておりEPNモチーフを持つ.マウスDCIR2の詳細な生理機能はいまだ不明であるが,ヒトホモログの研究から結核菌やHIV-1の感染への関与が示唆されており14, 15),最近では樹状細胞の免疫応答を制御することが報告されている16).このレクチンドメインはN型糖鎖の一種でバイセクト型糖鎖に特異的に結合するが,構造解析の結果から1-3アームのマンノース残基がCa2+に配位しており,先ほどのモチーフのルールに従っている.ここで生じる疑問点は1-6アームもマンノース残基を持っているが,1-6アームは結合に利用されないことである.これはマンノース残基以外の部分の相互作用から説明することができる.バイセクトGlcNAc残基とD233とのプラスアルファの相互作用は,1-3アームのマンノース残基がCa2+と配位した場合にのみ実現する5)(図2c右).一方,1-6アームのマンノースがCa2+と配位した場合,バイセクトGlcNAc残基とD233との距離が離れてしまい相互作用は実現されない.そのためマウスDCIR2は1-3アームのマンノース残基を選択的に認識しているものと考えられる.
レクチンの結合特異性は糖鎖構造の違いのみで決定されているのだろうか.仮にそうだとするとO-GalNAc糖鎖のようにサイズが小さく,広範に分布する糖鎖は,特異的な相互作用を実現するには不利な印象を与える.しかしこのような糖鎖構造でも特異性の高いシグナルとして働くことがわかってきた.
C-type lectin-like receptor-2(CLEC-2)は血小板上に発現しているC型レクチン様受容体で,細胞外にC型レクチン様ドメインを持つ.CLEC-2の生体内のリガンドはリンパ管上に発現した糖タンパク質ポドプラニンであり,ポドプラニンと相互作用することによって血小板凝集を引き起こす.ポドプラニンはリンパ管上に発現し,初期発生時に血小板上のCLEC-2と相互作用することで局所的な血小板凝集を引き起こし,血管からリンパ管が分化する際に体液が漏出するのを防ぐ17).さらに腫瘍細胞上でポドプラニンが過剰発現すると細胞表面に血小板が凝集するため,血管中のずり応力から細胞が守られ転移活性が亢進する18).ポドプラニンは162アミノ酸残基からなる一回膜貫通タンパク質で,細胞外領域にPLAG配列と呼ばれる生物種間で高度の保存された配列が3か所連続して並んでいる.そのうち三番目のPLAG配列(Glu-Asp-Asp-Val-Val-Thr-Pro-Gly, ThrにO-GalNAc糖鎖の修飾)がCLEC-2との結合に関わる.O-GalNAc糖鎖の化学構造は質量分析によって四糖からなるジシアリルコア1構造(NeuAcα2-3Galβ1-3[NeuAcα2-6]GalNAc)と決定された19).CLEC-2とポドプラニン糖ペプチドとの複合体のX線結晶構造解析の結果,驚いたことにPLAG配列の保存された二つの連続した酸性アミノ酸残基とα2-6結合したシアル酸残基の両方がCLEC-2と密に相互作用していた20)(図3a).PLAG配列中の結合モチーフ(Glu-Asp-X-X-X-Thr/Ser, Thr/SerにO結合型糖鎖修飾)を持つタンパク質がポドプラニン以外にどの程度存在するのかをUniProtKBのエントリーに対して調べたところ,興味深いことにポドプラニン以外にはほとんどそのモチーフは見いだされなかった.このジシアリルコア1構造はよく見いだされる典型的なO-GalNAc糖鎖であるが,このようにペプチド鎖との同時認識により生体内において十分に高い特異性を発揮することから,筆者らはO-GalNAc糖鎖に対する先入観を改める必要があると痛感した.
CLEC-2のようにO結合型糖鎖とアミノ酸残基の両方を同時に認識するレクチン受容体として,P-セレクチン,paired Ig-like type 2 receptor-α(PILR-α)が知られている20–22).P-セレクチンはC型レクチン受容体の一種で,生体内で細胞接着や免疫応答で重要な役割を果たしている.P-セレクチンは血管内皮細胞に発現するI型膜貫通タンパク質で,リガンドとの結合によって血小板を活性化する.P-セレクチンのC型レクチンドメインとP-selectin glycoprotein ligand 1(PSGL-1)由来のO-GalNAc型糖ペプチドとの複合体のX線結晶構造解析によると21),PSGL-1の二つの硫酸化チロシン残基とトレオニンに結合したO-GalNAc糖鎖(シアリルLewis-X)の両方がP-セレクチンとの結合に寄与している(図3b).こうした多点での結合によってP-セレクチンとPSGL-1は高い親和性(Kd=0.3 µM)と特異性を獲得し,生理機能につながっている.
PILR-αはマクロファージや顆粒球,樹状細胞といった免疫細胞表面に発現するI型膜貫通タンパク質でシグレックと同じIg-Vドメインを持ち,免疫細胞に抑制性のシグナルを伝える22, 23).PILR-αはCD9924, 25)や単純ヘルペスウイルスの糖タンパク質B(glycoprotein B:gB)26, 27)などのシアル酸が付加されたO-GalNAc型糖タンパク質と結合する.PILR-α Ig-Vドメインと単純ヘルペスウイルス由来gBのO型糖ペプチドとの複合体の結晶構造によると,α2-6結合したシアル酸(シアリルTn)がシグレックファミリーにみられる結合ポケットに収まり,さらに糖ペプチド中のプロリン残基がPILR-αと付加的に相互作用していた(図3c).PILR-αはストランドCとC′の間にあるCC′ループがO-GalNAc糖鎖とプロリン残基の両方と相互作用しており,リガンドとの特異性決定に寄与していた28, 29).
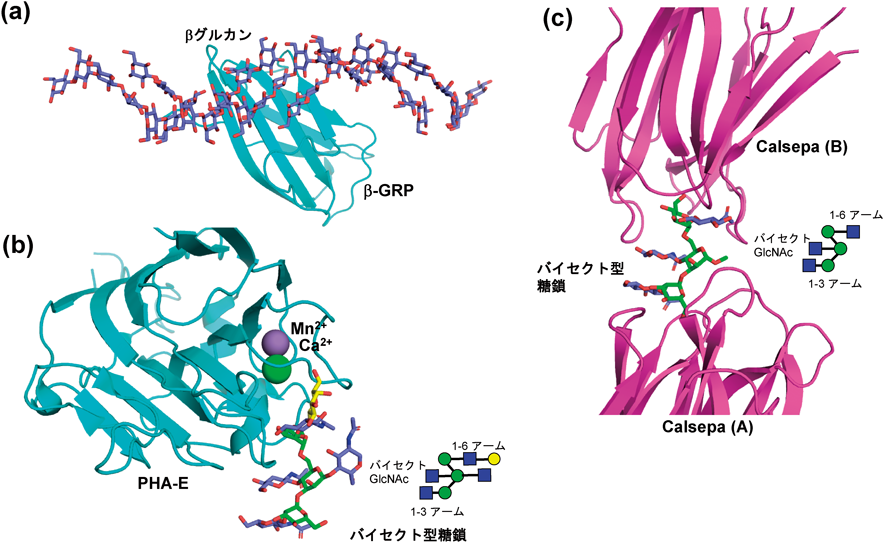
溶液中において糖鎖は一般に高い運動性を有するが,しばしば特定の高次構造を優先的に占める.我々は,特定の糖鎖の配列が特徴的な立体構造を形成し,その形を目印としてレクチンが認識するのであれば,糖鎖の化学構造を厳密に認識できなくても十分に高い特異性を発揮できると考え,それを「コンホメーション選択説」と呼んでいる9).たとえば真菌の細胞壁の構成成分であるβグルカンはグルコースがβ1-3結合で重合した多糖であるが,溶液中で三重らせん構造をとることがX線繊維回折の結果などから提唱されている30).昆虫由来(カイコBombyx moriやノシメマダラメイガPlodia Interpunctellaなど)のβ1-3 glucan recognition protein(β-GRP)はβグルカンに特異的なレクチン受容体であり,生体防御因子として機能している.β-GRPのレクチンドメインは8本のβストランドからなるイムノグロブリン様のβサンドイッチ構造を形成している小さなタンパク質である.β-GRPのレクチンドメインと短鎖βグルカン(重合度6~7)との複合体の結晶構造によると,1分子のβ-GRPが疑似三重らせん構造を形成した3本のβグルカン鎖にまたがって結合しており,1本のβグルカン鎖につき2残基,合計6残基のグルコース残基と相互作用しているという大変に驚くべきものだった31)(図4a).こうした糖鎖の高次構造の特徴をレクチンが認識することは小さなタンパク質のリガンド結合戦略として非常に理にかなっている.また,細菌(Bacillus halodurans)のβグルカン分解酵素BhGH81と短鎖グルカンの複合体の結晶構造においても複数のグルカン鎖を同時に認識しており,生理的な環境では三重らせん構造を認識することが示唆された32).糖鎖の高次構造を特異的に認識する戦略はレクチン以外にも広くみられるようである.
N結合型糖鎖についてもその配列と立体構造の相関が提唱されている.N結合型糖鎖の一種である二本鎖複合型糖鎖(バイアンテナ型糖鎖)はいくつかの準安定構造の動的な平衡状態として存在すると考えられている33).分子動力学シミュレーションや蛍光基を導入した蛍光共鳴エネルギー移動(FRET)などの実験からバイアンテナ型糖鎖はExtendコンホメーション(伸びた構造),バイセクト型糖鎖はBack-foldコンホメーション(折れ曲がり構造)をとりやすいことが提唱されている34, 35).我々はバイセクト型糖鎖に特異的なレクチンであるPHA-EおよびCalsepaとバイセクト型糖鎖との複合体に対してX線結晶構造解析と溶液NMR解析を行い,糖鎖認識様式を詳細に調べた.その結果,二つのレクチンPHA-EとCalsepaは,それぞれまったく異なるフォールドをしているにもかかわらず,ともにBack-foldコンホメーション(折れ曲がり構造)をしているバイセクト型糖鎖を認識していた36)(図4b, c).特にCalsepaレクチンは2分子のレクチンがBack-foldコンホメーションによって生じる擬似的な二回対称構造をした糖鎖をはさみ込んで認識していた(図4c).レクチン存在下でバイセクト型糖鎖の溶液NMR測定を行い,転移NOEの解析からレクチンに結合した状態の糖鎖がBack-foldコンホメーションを示すことを確認した.
これらの例はいずれもレクチンが糖鎖の配列を細かくみるというよりは,糖鎖が優先的にとりやすいコンホメーションを形として捉えることで,結果としてリガンド糖鎖を特異的に認識しており,レクチンの合理的な戦略を垣間みることができた.それとともに,糖鎖分子を単なる配列情報としてみなすのではなく,その高次構造やダイナミクスを考慮することの重要性をあらためて認識させられた事例であった.
5. 特定のタンパク質に提示される糖鎖とその認識様式
質量分析などの分析技術の進歩や試料調製の工夫などによって,新しい糖鎖修飾様式が発見されている.糖鎖構造がユニークで発現が限局している場合は,その糖鎖をシグナルとして生体が利用することは,情報を特異的に伝達するシステムとして合理的であり理解しやすい.本節では特定のタンパク質に提示されるユニークで非典型的な糖鎖として,α-ジストログリカン上のO-マンノース糖鎖およびNotch上のO -フコースおよびO-グルコース糖鎖について紹介する37, 38).
骨格筋にあるジストログリカン複合体の構成タンパク質であるα-ジストログリカン(α-DG)は,非常に特徴的な糖鎖修飾(O-マンノース糖鎖修飾)を受ける39).α-DGは細胞外マトリックスであるラミニンとこのO-マンノース糖鎖を介して結合しており,O-マンノース糖鎖が形成不全に陥ると,ジストログリカノパチーと総称される一連の疾患を誘発するようになる.α-DG上の糖鎖修飾様式は最近になりすべての糖鎖構造が決定された40, 41)(図5a).この中で糖転移酵素LARGEは触媒ドメインを二つ持ち,単独でマトリグリカンと呼ばれるグルクロン酸(GlcA)とキシロース(Xyl)の二糖の繰り返し構造(-3GlcAβ1-3Xylα1-)nを作り出す.このマトリグリカンはヘパラン硫酸やコンドロイチン硫酸など比較的広範に見いだされる他のグリコサミノグリカンとは異なり,α-DGに特徴的である.ラミニンはLGドメインを使ってこのマトリグリカンを認識してα-DGと結合する.α2ラミニンのLGドメイン(LG4-LG5)とマトリグリカンとの複合体の結晶構造から,LG4ドメインがカルシウムイオンを介してグルクロン酸とキシロースの繰り返し構造を認識していることが明らかになった42, 43)(図5b).興味深いことに,キシロースのC5原子はLGドメインと近接していた.キシロースはペントース(五炭糖)であり,基本的に六炭糖で構成されている他のグリコサミノグリカンは立体障害を起こしてしまい結合できない.
O-マンノース型糖鎖(マトリグリカン)はα-DGのムチンドメインの特定の数か所にしか付加されず,糖転移酵素によって厳密に制御されていることが考えられる.一連のO-マンノース糖鎖修飾は最初にPOMT1/2複合体によってマンノース残基が付加され,続いて糖転移酵素および糖リン酸化酵素44, 45)によって一段階ずつ反応が進行する.興味深いことに糖転移酵素であるPOMGNT1はラミニンとの相互作用に必要な糖鎖生合成に直接関与しないにもかかわらず,その遺伝子の変異は先天性筋ジストロフィー症を発症する.POMGNT1の構造解析の結果,POMGNT1は触媒ドメインとは別にレクチンドメインを持ち,フクチン(FKTN)などの一連の糖転移酵素の集積に重要であることが示唆された46).今後はPOMT1/2複合体を含む一連の糖転移酵素の基質選択性や制御機構に関する研究の進展が期待される.
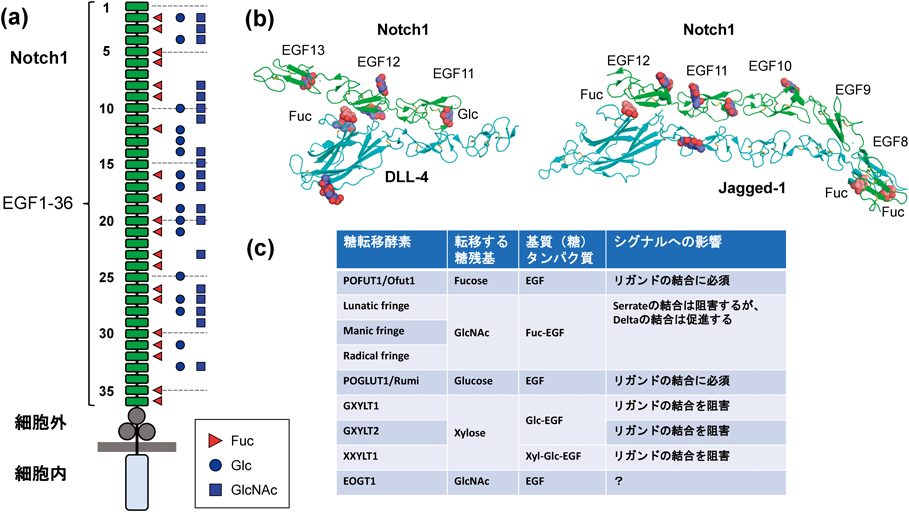
一方のNotchは血管新生や白血病,乳がん,前立腺がんなどに深く関与する一回膜貫通受容体で,細胞外に36個のEGFモジュールと3個のLNR(Lin12-Notch Repeat)ドメインからなる巨大なモジュラー構造を持ち,細胞内に転写因子として働くドメインを持つ(図6a).NotchのリガンドはDeltaやJaggedといった膜貫通タンパク質で標的細胞表面に発現しており,細胞間接着によってNotchの細胞外ドメインとリガンドの細胞外領域が結合し,何らかの要因によってずり応力が発生すると,Notchの膜貫通部位近傍が構造変化することでγセクレターゼなどのタンパク質分解酵素による切断を受け,転写因子部分が核内に移行し標的遺伝子の転写を誘導する.NotchのEGFモジュールはPOFUT1(Ofut1)やPOGLUT1(Rumi)などの糖転移酵素によってO-フコースやO-グルコースなどといったO結合型糖鎖が部位特異的に付加され47),糖鎖修飾依存的にリガンドと結合する.
Notch1の細胞外ドメインとリガンドであるDelta-like 4(DLL4)とJagged-1の細胞外ドメインとの複合体の結晶構造がそれぞれ解かれ,糖鎖修飾依存的にリガンドと結合するメカニズムが明らかになった37, 38).Notch1とDLL4の結合界面の中心にはO-フコースやO-グルコースが存在し,結合に重要な役割を果たしている.またNotch1とJagged-1との結合界面はDLL4の相互作用界面と共通部分を多く持ちながら独自の界面も結合に寄与している.興味深いことにDLL4との結合にはO-フコースとO-グルコースが1残基ずつ寄与していたが,Jagged-1との結合には3残基のO-フコース残基が寄与していた(図6b).
Notchの糖鎖修飾による活性制御は非常に複雑で,糖転移酵素の種類によって結合に必須なもの,結合を促進するもの,結合を阻害するものがある(図6c).糖転移酵素POFUT1やPOGLUT1(Rumi)などのO-フコースおよびO-グルコース糖鎖修飾はリガンドとの結合やタンパク質の安定化に必須であり,糖転移酵素FringeのO-フコースに対するGlcNAc修飾はリガンドの種類に依存して結合を阻害あるいは促進する.またUDP-xylose:glucoside α1-3 xylosyltransferase 1, 2(GXYLT1, 2)やUDP-xylose:xyloside α1-3 xylosyltransferase 1(XXYLT1)のO-フコースに対するキシロース修飾はリガンドの結合に対して阻害的に働く48, 49).構造解析の結果から各リガンドとの結合に糖鎖が寄与しており,糖鎖が伸展されることで新たな相互作用が生じる,あるいは逆に立体障害を引き起こすことで結合が制御される機構が提唱されている.
一方でこのような複雑なシステムを成立させるためには,基質特異的かつ部位特異的に目的の糖鎖が修飾される必要がある.特異的な糖鎖修飾はどのようなメカニズムによって実現するのであろうか? 最近になりNotchを修飾する糖転移酵素であるPOFUT1やRumiと基質であるEGFモジュールとの複合体の立体構造が相次いで報告された50, 51).これらの糖転移酵素はEGFモジュール全体を活性部位深くに引き入れて細部にわたって密に相互作用することによって基質を選別し,特定のEGFモジュールのみに糖を転移することが明らかになった.このようにNotchによる細胞外のリガンド相互作用は基質選択性の高い糖転移酵素と糖鎖を中心に据えたリガンド-受容体間相互作用によって厳密に制御されている.
基質特異的な糖鎖修飾はO結合型糖鎖修飾のみならずN結合型糖鎖修飾でもみられる.たとえばポリシアル酸転移酵素(ST8Sia-IV)は神経細胞接着因子NCAM上の特定のN結合型糖鎖の末端にシアル酸が重合したポリシアル酸を付加する.類縁酵素のST8Sia-IIIの結晶構造からNCAMとの静電的な相互作用によって基質を選別する機構が提唱されている52, 53).今後糖転移酵素の構造解析が進むにつれて基質特異的・部位特異的な糖鎖修飾のメカニズムも次第に明らかになっていくであろう.
6. 細胞内にシグナルを伝えるメカニズム—C型レクチン受容体を例として—
多くのレクチンが自然免疫系の受容体として働き,外来異物由来の糖鎖と結合する.たとえばC型レクチン受容体は,パターン認識受容体としてウイルスや外来異物由来の糖鎖などを認識するC型レクチンドメインを持ち,αヘリックスからなるネック領域,一回膜貫通領域を経て,短い細胞内領域へとつながっている.細胞内領域には,それぞれの受容体が下流へのシグナル伝達に必要なITAM, hemITAM, ITIMなどのモチーフを持っている54, 55).こうしたモチーフはリン酸化されるチロシン残基を持ち,レクチン受容体がリガンドと結合すると,SykやSrcなどのチロシンリン酸化酵素をリクルートして,さらに下流へとシグナルを伝達する.ここで注目すべきは,レクチン受容体の細胞内領域の周囲にはチロシンリン酸化酵素だけでなくCD45やCD148などのチロシン脱リン酸化酵素も共存しており,そのバランスがシグナル伝達効率に大きな影響を与えていることである.このような状況において細胞外の糖鎖リガンドの結合がどのようにして細胞内にシグナルとして伝わるのかについて議論したい.
C型レクチン受容体の立体構造を精査すると,多くの場合糖鎖が結合してもレクチンドメインに大きな構造変化は起こっていない.それでは構造変化を伴わずになぜ細胞内にシグナルが伝わるのであろうか? この問題に取り組むにあたり,一つの重要なポイントは,糖鎖とレクチン受容体は一対一の相互作用をするのではなく,糖鎖リガンドは通常多価であることである.すなわち多価の糖鎖との相互作用によって受容体の多量体化や高密度化が引き起こされるのである56).C型レクチン受容体の糖鎖リガンドにはさまざまなものがあるが,糖鎖のサイズはシグナル伝達強度に強く相関することが知られている.たとえばDectin-1は骨髄性食細胞上に発現し,真菌類の細胞壁を構成するβグルカンに対する受容体として働くが,サイズの異なるβグルカンを用いた実験から,可溶性でサイズの小さなβグルカンではDectin-1を通したシグナル伝達が起こらないのに対して,サイズが大きく不溶性のβグルカンを用いると強いシグナルが誘起される57).Dectin-1は細胞内にhemITAMを持ちSrc/Sykなどのリン酸化酵素をリクルートして活性化するが,巨大なリガンドが結合すると受容体が高密度に集積し,“phagocytic synapse”と名づけられた構造体を形成することでCD45やCD148などの脱リン酸化酵素を排除し,シグナル伝達を効率的に行う機構が提唱されている.
またC型レクチン受容体の多くは,ネック領域のαヘリックスによってコイルドコイル構造を形成して多量体を形成する.たとえばC型レクチン受容体の一種であるDC-SIGNはHIVなどのウイルスの受容体として働くことが知られているが,ネック領域に遺伝子多型が存在し,長さにバラつきがある.生化学的解析から,このネックの長さが変化することによって単量体から四量体まで変化し,それによってタンパク質の安定性やウイルスに対する感受性が変化するという興味深いモデルが提唱されている58).またC型レクチン受容体は一般に受容体の種類によってネック領域を介した多量体形成機構が異なり,二~四量体まで幅広く形成しうる.こうした多量体化の違いは各C型レクチンドメインの糖鎖結合部位間の距離の違いを生じ,ひいてはリガンドとなる糖鎖との結合様式にも影響を与える可能性がある59).βグルカンの受容体であるDectin-1はレクチンドメインを単独で組換えタンパク質として発現すると,リガンド非存在下では単量体として存在するが,βグルカンリガンドと結合すると協調的に四量体を形成した60).この結果からDectin-1は協調的なオリゴマー形成により細胞表面で効率よくβグルカンを感知して,細胞内シグナリングを誘起するメカニズムを備えている可能性があり,現在この点をさらに調べている.
興味深いことに結核菌外壁に存在する糖脂質(mycobacterial cord factor)に対するC型レクチン受容体Mincleは,同じくC型レクチン受容体であるMCLとヘテロ二量体を形成することで活性化することが知られている61).こうした異なる2種類のレクチンが共存することで,より厳密にリガンド構造を識別できると考えられる.
レクチンの多量体化によって活性が上昇するのは,膜貫通受容体に限った話ではない.可溶性の血清レクチンであるマンナン結合タンパク質(mannan-binding protein:MBP)は,C型レクチンドメイン,コラーゲン様ドメイン,ネック領域から構成されており,コラーゲン様ドメインや分子間のジスルフィド結合を介して多量体を形成している.MBPの多量体化は生理機能に直結しており,多量体を形成することによって補体活性化能が上昇する62).レクチンの多量体化による活性調節機構はレクチンと糖鎖の相互作用の特徴をよく反映している.つまり一点一点のレクチンと糖鎖との結合は親和性が低く外れやすいが,密度を上昇させることで飛躍的に結合が増強される.これはマジックテープのようなものを想像すると理解しやすい.
8. レクチンとの結合に直接関与しない領域が親和性に与える影響:植物レクチンOrysataを例にして
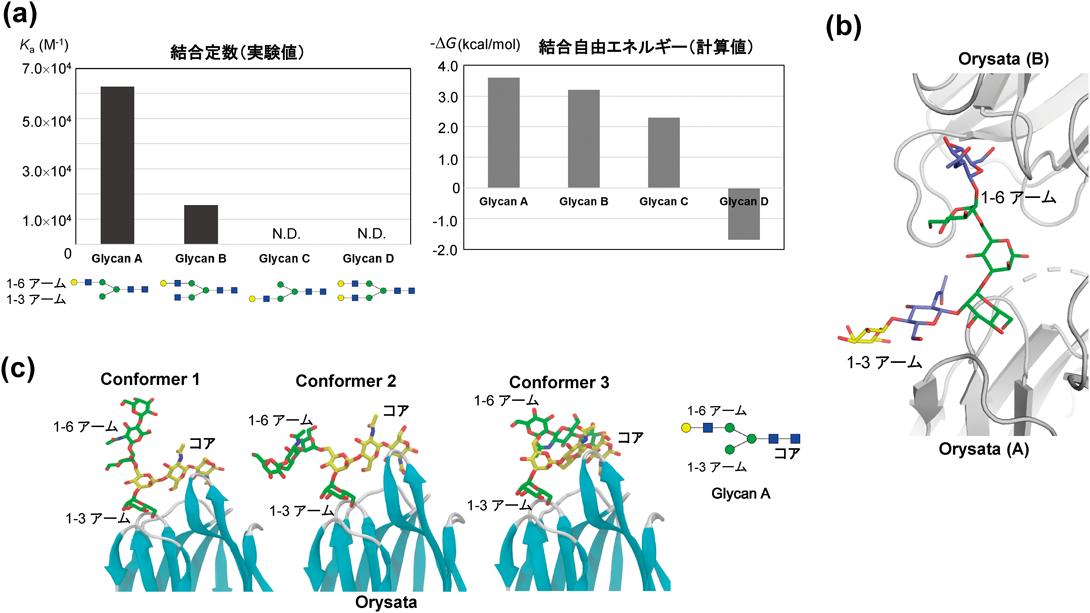
糖鎖は多様な化学構造を持ち,その暗号を読み解くレクチンと連動することにより非常に優れた情報伝達システムとして機能することができる.レクチンがさまざまな戦略で標的糖鎖との結合特異性を獲得している点は興味深く,これを創薬に応用することも可能である.レクチンのリガンド特異性は通常糖鎖マイクロアレイやフロンタルアフィニティクロマトグラフィーなどによって調べられるが,レクチンによっては複雑なリガンド結合プロファイルを示す場合があり,単純にヒットする糖鎖の化学構造をながめていただけでは解釈できない場合もある68).本節ではこの実例をあげて今後解決すべき問題の一つとして提起したい.Orysataレクチンは塩ストレスによって誘導される植物レクチンの一種で,ストレス応答や昆虫からの防御因子として機能している.ジャカリン関連マンノース結合レクチンに分類され,基本的にはマンノースを認識する.フロンタルアフィニティクロマトグラフィーの結果によるとバイアンテナ型糖鎖のうち,1-3アームに比べて1-6アームが伸長した糖鎖に対して親和性を示した(図7a)68).この結果は1-6アームがレクチンに認識されているとの印象を受ける.しかし1-3アームが伸長したバイアンテナ型糖鎖との複合体の結晶構造ではOrysataは1-3アームと1-6アームの両方を認識しており,フロンタルアフィニティクロマトグラフィーの結果を十分に説明できるものではなかった(図7b).そこで溶液中では二つの結合状態が混在していると考え,それぞれの分岐鎖がOrysataと結合した場合について分子動力学シミュレーションを行い,系全体の結合自由エネルギーを算出した.得られた結果は糖鎖アレイの結果と定性的によく一致した(図7a).注目すべきは,1-6アームとコア領域の糖鎖内の相互作用による構造の安定化が系全体の結合自由エネルギーに重要であり,レクチンとの結合に直接寄与しない糖残基も親和性に寄与することであった(図7c).このような非結合領域の親和性に対する寄与は柔らかい糖鎖ならではの特徴であり,他のレクチンにおいても最近報告されている69).今後レクチンによって直接認識されない領域の親和性に与える影響について大いに注意を払う必要がある.
本稿では糖鎖とシグナリングと題して,レクチンによる糖鎖の多様な認識機構により糖鎖が生体内でsugar codeとして働いていることを紹介した.レクチンのリガンド認識に対する構造生物学的研究は徐々に進んできたものの,それに比べるとレクチンのシグナル伝達メカニズムに焦点を当てた構造生物学的研究はほぼ未開拓の状況にあるといってよい.膜の内外を通した情報伝達機構は動的で複雑な過程であり,構造生物学的な研究に加えて,一分子計測やシミュレーションなど周辺分野との連携がいっそう重要になるであろう.また,最後の節で述べたように動的で柔らかい糖鎖の挙動を真に理解するためには,X線結晶構造解析のみならず,NMR法や計算科学と緊密に連動した研究が必要不可欠である.
また糖タンパク質上の特定の部位に結合している糖鎖を任意の糖鎖構造に改変する試みは精力的になされているものの70),いまのところ万能で普遍的な技術は確立されていない.糖タンパク質の糖鎖改変には,糖鎖修飾部位を他のアミノ酸へ置換した点変異体による「0か1か」という方法,あるいはエンドグリコシダーゼなどによる酵素処理もしくはCHO-Lec細胞やHEK293 GnT-I欠損細胞などを宿主とした発現系による「タンパク質上の糖鎖を一括変換する」という方法しかない.特定の糖修飾部位の特定の糖鎖がもたらす生理的機能を評価できるような新たな実験法・技術の開発が間違いなく必要である.筆者らは現在その第一歩として目的の糖鎖構造を持つ糖タンパク質の酵素合成法の検討を進めており71),今後10年以内に技術を確立して糖タンパク質・レクチンの構造生物学研究・機能研究に活かしたい.