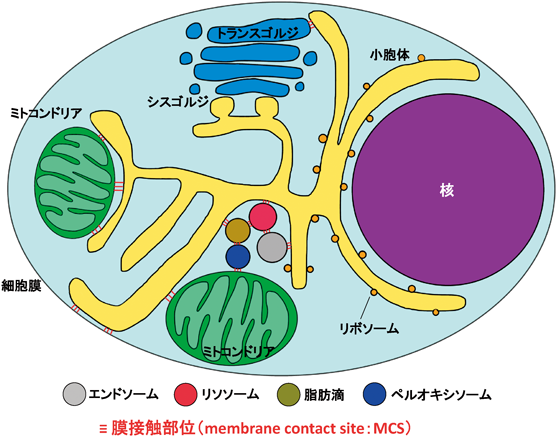
真核細胞には種々の細胞小器官(オルガネラ)が存在しており,個々のオルガネラが適切に機能を発揮することが細胞の生存・増殖・分化等に必要不可欠である.そして,この過程においてはオルガネラ間でのコミュニケーションがきわめて重要な役割を担っている.オルガネラ間コミュニケーションの手段の一つとして「細胞内小胞輸送」がある1).細胞内小胞輸送の分子機構に関する研究は1980年代ごろから精力的に行われるようになり,その中心として研究を牽引してきたSchekman博士(カルフォルニア大学バークレイ校),Rothman博士(イエール大学),Südhof博士(スタンフォード大学)が2013年にノーベル生理学・医学賞を受賞したことは記憶に新しい.輸送小胞は微小管やアクチンなどの細胞骨格に沿って運搬されるため,細胞内小胞輸送のシステムでは離れたオルガネラ間におけるコミュニケーションが可能である2).しかしながら,近年になり異なるオルガネラどうしが直接的な接触や近接を介してコミュニケートしていることも明らかになりつつある.オルガネラ間の接触場は膜接触部位(membrane contact site:MCS)と呼ばれ,その中心に位置するオルガネラが小胞体(ER)である.そして,小胞体はミトコンドリア・細胞膜・エンドソーム・リソソーム・ゴルジ体・脂肪滴・ペルオキシソームなど多様なオルガネラとMCSを形成し,MCSにおいて各オルガネラとコミュニケートすることにより多彩な機能を発揮している3)(図1).
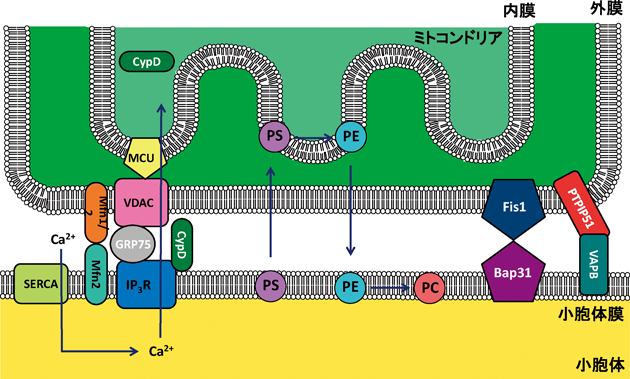
小胞体が形成するMCSにおいて活発に研究が行われている領域の一つに,ミトコンドリアとの接触場(mitochondria-associated membrane:MAM)があげられる.MAMでは脂質合成やCa2+の放出が盛んに行われているので,脂質合成酵素やIP3受容体およびSERCAといったCa2+の動態を制御するタンパク質が濃縮されている4)(図2).また,脂質合成酵素が豊富に存在していることから,MAMの一部はコレステロールやスフィンゴ脂質に富むラフト様の構造(細胞膜のカベオラと類似した構造)であると考えられている5, 6).さらに,近年のMAMに関連した研究の進展は目覚ましく,MAMはミトコンドリアダイナミクス・オートファジー・小胞体ストレス応答の制御のみならず,抗ウイルス作用や自然免疫応答にも関わっていることが明らかになりつつある.このように,MAMは細胞内において多彩な生理機能のプラットホームとして重要な役割を担っているが,その構造や機能の維持に働くタンパク質の存在も明らかになりつつある.その一つがGTPaseであるマイトフュージン(Mfn)である.ミトコンドリアに局在しているMfnにはMfn1およびMfn2という二つの分子種が存在しており,ホモおよびヘテロ二量体を形成することによりミトコンドリアどうしの融合に関わることが知られている7).さらに,2007年Scorrano博士らのグループはMfn2の一部がMAMに局在し,小胞体膜とミトコンドリア膜との繋留に関わることを明らかにした8)(図2).それゆえ,Mfn2の機能阻害は小胞体とミトコンドリアの解離を引き起こし,MAMより放出されるCa2+の量の減少を引き起こす8).また,小胞体–ミトコンドリアの繋留にはIP3受容体-GRP75-VDAC-CypD複合体やBap31-Fis1複合体なども関わっており,前者はCa2+ホメオスタシスに,後者はアポトーシスと密接に関わっている9, 10)(図2).なお,家族性筋萎縮性側索硬化症ALS8の原因遺伝子として知られているVAPBはミトコンドリアに局在するprotein tyrosine phosphatase-interacting protein 51(PTPIP51)と結合してMAM-ミトコンドリアの繋留に関わっており,この相互作用はTDP-43(ALS10原因因子)により調節されている.それゆえ,MAM-ミトコンドリアの繋留異常がALSの発症に関わることが示唆されている11).さらに,PACS2と呼ばれるタンパク質はMAMにおいてcalnexin(CNX)と相互作用することにより,MAMの構造維持に関わることが知られている12, 13).
Stx17は2000年にScheller博士らの研究グループにより膜融合装置として働くSNAREタンパク質の一つとして発見され,滑面小胞体に局在し小胞体–ゴルジ体間の輸送小胞に含まれているv-SNAREのSec22bとSNARE複合体を形成していることが明らかになっている14).2000年に発見されて以降,Stx17の機能解析に関連するきわだった報告は滞っていたが,最近になり最も注目されるSNAREタンパク質の一つとなった.それは,Stx17がオートファジーに重要な役割を担っていることが明らかになったからである.オートファジーは栄養飢餓などのストレスにより誘導される現象であり,小胞体より形成された隔離膜が細胞質成分や一部のオルガネラを包み込んだオートファゴソームとなる.その後,オートファゴソームはリソソームと融合し,内容物を分解することによりエネルギーやアミノ酸などの生体高分子の原料を産生する.隔離膜が小胞体のどのドメインから形成されるのかは長い間議論があったが,2013年に大阪大学の吉森博士らは隔離膜がMAMから形成されることを発見した15).隔離膜の形成にはホスファチジルイノシトール3-リン酸(PI3P)が産生される必要があり,その産生をつかさどっている酵素がPI3P-キナーゼ(PI3K)複合体である16).吉森博士らのグループは栄養飢餓に伴いStx17がPI3K複合体の構成因子の一つであるAtg14Lとの相互作用を介してPI3K複合体をMAMへとリクルートし,隔離膜形成を促す役割を担っていることを明らかにした15).一方,水島博士らは,オートファゴソームに局在化したStx17はリソソーム上のv-SNAREであるVAMP8との相互作用を介して,オートファゴソームとリソソームとの膜融合に必要であることを報告しており17),Stx17はオートファジーにおいて,その開始点(隔離膜形成)から終着点(オートファゴソームとリソソームとの融合)まで幅広く機能しているタンパク質である.
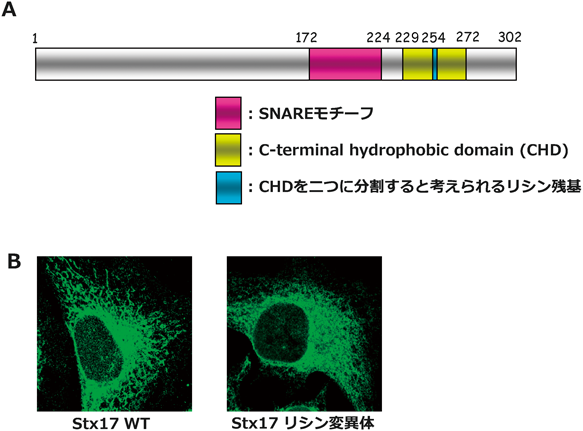
筆者らは,通常状態(栄養条件)におけるStx17の機能に着目して解析を行った.まず栄養条件でのStx17の細胞内局在を免疫染色や細胞分画により調べたところ,免疫染色においてStx17はミトコンドリアマーカーと顕著な共局在を示し,細胞分画においては小胞体・MAM・ミトコンドリア画分にプロファイルされた.また,コレステロールに特異性のある界面活性剤であるジギトニンで細胞を処理すると,Stx17のMAMやミトコンドリア局在が消失することからStx17はMAM上のラフト様構造に豊富に存在すると推測された.これらの結果より,栄養条件におけるStx17の局在が明らかにできたので,次にStx17の局在化分子機構の解析に着手した.その際に注目したのが,Stx17のC末端に存在する疎水性領域である.通常,SNAREタンパク質はC末端に位置するSNAREドメイン(膜融合に必須なドメイン)の後に短い膜貫通領域を有するが,Stx17には254番目のLysにより二分される44アミノ酸からなる長い疎水性領域(C-terminal hydrophobic domain:CHD)が存在する(図3A).なお,このCHDはヘアピン様の構造であると考えられており,CHDに続くC末端のテイル領域はサイトゾル側を向いている14, 17).ヘアピン様構造を形成する疎水性領域において,その領域を二分するアミノ酸残基が機能や局在化に重要な役割を担っていることから,Stx17の254番目のLysの変異体を作製しその局在を解析した.その結果,野生型ではMAMやミトコンドリアを示すチューブ状として観察されるStx17の局在が,Lys254の変異により消失した(図3B).よって,Stx17はCHDを二分しているLysを介してMAMやミトコンドリアへと局在化していると考えられる.
ここまでの解析により,栄養条件におけるStx17の局在と局在化機構の一端は明らかとなった.では,「栄養条件においてMAMやミトコンドリアに局在するStx17にはどのような生理機能があるのか?」が次なる疑問となる.そこで,Stx17を発現抑制した細胞における種々のオルガネラ形態の観察を行った.Stx17は小胞体に局在するSNAREタンパク質として発見され14),通常SNAREタンパク質は膜融合や膜輸送に重要な役割を担っていることから,解析当初はStx17の発現抑制による初期輸送に位置するオルガネラ(小胞体・小胞体–ゴルジ体中間区画(ERGIC)・ゴルジ体)への影響を解析した.しかしながら,Stx17の発現抑制ではこれらオルガネラへのきわだった影響は観察されなかった.Stx17がMAMやミトコンドリアにも局在していることを見いだしていたことから,次にStx17の発現抑制がミトコンドリアの形態に与える影響を調べた.ミトコンドリアは融合と分裂を繰り返すダイナミックなオルガネラであり,外膜と内膜の二重膜により構成されている.ミトコンドリアの融合や分裂にはGTPaseが関わっており,融合においてはMfn1/2(外膜)やOPA1(内膜)が,分裂においてはDrp1が必須な役割を担っている7, 18, 19).通常の細胞においてミトコンドリアは一定の長さで分断されたチューブ状の形態として観察される.一方,Stx17を発現抑制した細胞において細く伸長したミトコンドリアが有意に増加していた.また,この「細く伸長する」形態はミトコンドリアの分裂活性が抑制された際に頻出する現象であることから20),Stx17は栄養条件においてミトコンドリア分裂を促進している可能性が推測される.そして,この可能性を強く支持する報告がなされた.2011年にコロラド大学のVoeltz博士らは,ミトコンドリアの分裂が起こる部位に小胞体膜が巻きつき(MAM),そこにDrp1が集積・会合することで分裂が引き起こされることを明らかにした21).この報告はMAMがミトコンドリアの分裂に必要であることを示しており,MAMに局在するタンパク質もミトコンドリアの分裂制御を担っていることを意味する.それゆえ,Stx17がMAMにおけるミトコンドリア分裂制御因子として機能していても不思議なことではない.そこで,ミトコンドリア分裂制御におけるStx17の詳細な分子機構の解析に着手した.
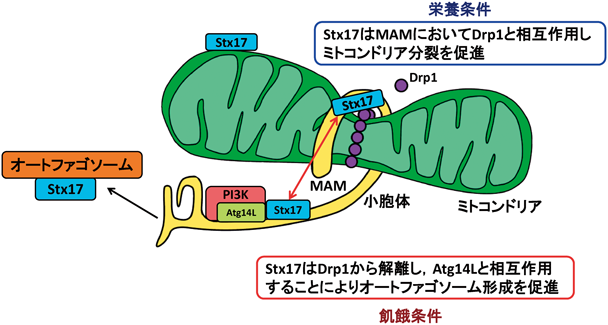
Stx17はSNAREタンパク質であることから,Stx17単独でミトコンドリアの分裂を促進しているとは考えにくく,何らかの因子を制御することでミトコンドリア分裂に寄与している可能性が推定される.ミトコンドリアの分裂は小胞体膜(MAM)とDrp1の双方の機能を必要とすることから,MAMに局在しているStx17はDrp1の機能を制御している可能性が考えられる.その可能性を検証するために,まずStx17とDrp1との相互作用(近接)を免疫沈降およびproximity ligation assay(PLA)により調べた.免疫沈降法において,Stx17はDrp1とCHDとそれに続くC末端サイトゾル領域(CHD+Cドメイン)を介して相互作用しており,この相互作用にはDrp1の活性化(GTPとの結合)が必要であることが見いだされた.また,Stx17を発現抑制した細胞に野生型のStx17およびStx17のLys変異体や種々のドメイン欠失変異体を入れ戻し,ミトコンドリアの形態を観察したところ,野生型・SNAREドメイン欠失変異体・CHD+Cドメインを発現している細胞では分裂したミトコンドリア(形態の回復)が観察されたが,Lys変異体やCHD+C欠失変異体では回復がみられなかった.さらに,PLAにより,Stx17とDrp1はミトコンドリアの分裂部位において近接しており,この近接には小胞体–ミトコンドリアの繋留やMAMの構造が必要(Mfn2やPACS2の発現抑制により近接シグナルが消失)であることを明らかにした.これらの結果は,栄養条件においてStx17はCHD+Cドメインを介してMAM上でDrp1と相互作用することによりミトコンドリアの分裂を促進していることを示している.それゆえ,Stx17とDrp1との相互作用が消失することによりミトコンドリアの分裂阻害(伸長)が引き起こされるはずである.このことを検証するために,微小管を脱重合させた細胞におけるStx17とDrp1との相互作用を解析した.以前の報告により,微小管を脱重合させた細胞において,ミトコンドリアの分裂阻害に伴う伸長が起こることが明らかとなっている22).そこで,ノコダゾールを添加した細胞におけるStx17とDrp1との相互作用を調べたところ,微小管の脱重合によりStx17とDrp1が解離していた.また,微小管を脱重合させた細胞においてStx17がジギトニンに感受性を示さないドット構造として観察されたことから,Stx17とDrp1との相互作用はMAMのラフト様構造で起きていることが明らかになった.
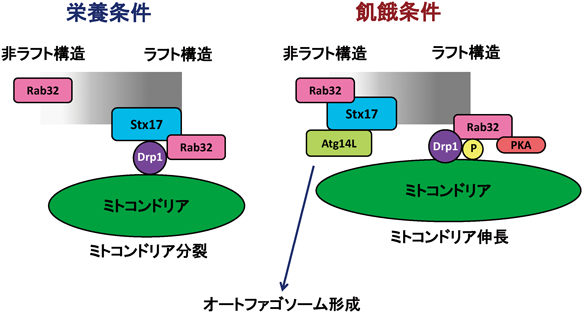
ミトコンドリア分裂ではDrp1のMAM/ミトコンドリアへの集積および活性化(オリゴマー化)が必須であるが,その過程はさまざまな分子が制御している.サイトゾルに分布していたDrp1はMff・Mid49・Mid51・Fis1などの受容体を介してMAM/ミトコンドリア膜へとリクルートされた後に活性化される23–25)が,活性化される過程においてDrp1の637番目のSer残基(S637)の脱リン酸化が必要となる26).また,このリン酸化にはプロテインキナーゼA(PKA)が関わっており,Rab32がDrp1とPKAを仲介することが明らかとなっている27).それゆえ,Stx17はDrp1との相互作用を介してi)Drp1のMAM/ミトコンドリア膜へのリクルート,ii)Drp1のS637の脱リン酸化のどちらかを制御していると考えられる.もし,Stx17がDrp1のMAM/ミトコンドリア膜へのリクルートに関与しているのであれば,Stx17の発現抑制によりサイトゾルに局在するDrp1の量が増加するはずである.しかしながら,Stx17を発現抑制している細胞においてもMAM/ミトコンドリアに局在するDrp1の量に有意な変化は検出されなかった.一方,Stx17を発現抑制した際にリン酸化S637の量が著しく増加していたことから,Stx17はDrp1のS637の脱リン酸化を促進することによりミトコンドリアの分裂を制御していることが強く示唆された.さらに筆者らは,Stx17がラフト様構造のMAMにおいてRab32と結合すること,Stx17とともにRab32の発現抑制を行うとStx17の発現抑制により亢進したDrp1のS637のリン酸化レベルが低下することを見いだしており,Stx17はDrp1との相互作用を介してRab32-PKA依存的なDrp1のリン酸化を抑制することでDrp1の活性化を促進していることを明らかにした(図4;栄養条件下).
このように,Stx17は栄養条件においてDrp1と相互作用し,その活性化を制御することによりミトコンドリアの分裂に働くことが示された.しかしながら,栄養飢餓状態になるとStx17はAtg14との相互作用を介してオートファゴソーム形成を惹起し,その後にオートファゴソームとリソソームとの融合にSNAREとして働くタンパク質である15).すなわち,Stx17は栄養状態に応じて二つの役割を担っていることになる.では,この二つの役割は独立した機能であるのか,それとも相関した機能であるのか,という問いが提起される.そこで,栄養条件および飢餓条件におけるStx17とその結合タンパク質との相互作用の状態を解析した.まずStx17とAtg14Lとの相互作用は,報告どおりに飢餓条件において亢進がみられた.一方,栄養条件で検出されたStx17とDrp1との相互作用は,飢餓条件において消失していた.さらに,飢餓条件ではStx17の局在がラフト様構造から非ラフト様構造へと移行していることも明らかとなった(図4;飢餓条件下).この結果は,Stx17が栄養状態に応答してその結合パートナーと機能を変換する分子スイッチとして振る舞っていることを示している(図5).Lippincott-Schwartz博士らのグループは,細胞が飢餓状態に陥るとミトコンドリアが伸長することでオートファゴソームへの取り込みを回避していることを報告している28).さらに,伸長したミトコンドリアは分裂したミトコンドリアよりも多くのATPを産生することで29),飢餓時における効率的なエネルギー供給を可能としている.よって,飢餓条件下におけるStx17とDrp1の解離は,飢餓時にミトコンドリアが伸長するという現象の分子機構の一端であることを明らかにできたものと考えている.そして,これらの結果を2015年にDevelopmental Cellにて報告した30).
4. レジオネラ(Legionella pneumophila)
1976年,米国フィラデルフィアで開催されていた在郷軍人会において参加者や周辺住民が肺炎様の症状を併発した.そこで,抗生物質(当時,肺炎の治療に用いられていた薬剤)による治療が行われたが,顕著な効果が得られず罹患者の約15%が死亡する事態となった.その後,死亡した患者の肺より新種のグラム陰性桿菌が分離され,在郷軍人会(Legionnaire)にちなんでLegionella pneumophilaと名づけられた.肺炎の原因菌としてのレジオネラの発見は1976年と比較的最近のことであるが,自然界では河川や土壌などに古くから存在している菌である.また,自然界においては,アメーバやタマホコリカビなどの原生生物を宿主としている.それゆえ,レジオネラが感染したアメーバやタマホコリカビなどが形成するバイオフィルム(微生物や原生生物など種々の生物の集合体により形成されるコロニー;例として,排水パイプのヌメリなど)を含む水源(温泉・循環風呂・空調装置)より発生するエアロゾルが感染の引き金となる.
肺に到達したレジオネラは,肺胞に存在するマクロファージにファゴサイトーシスを介して取り込まれ,Legionella-containing vacuole(LCV)と呼ばれる膜構造体を形成する.通常,ファゴサイトーシスとは細胞外の異物を取り込みリソソームへと輸送した後に分解する機構であるが,レジオネラはLCVのリソソームへの輸送を遮断する31).さらに,レジオネラはLCVに宿主細胞の小胞体より出芽した輸送小胞(ER小胞)を取り込み融合させる32).その結果,LCVの膜組成がERGICやゴルジ体に近似した構造となり32),この膜構造の変換によりLCVは小胞体と融合し,最終的にレジオネラは宿主小胞体内で増殖することで病原性を発揮する33).そして,この一連の感染機構にはレジオネラが宿主細胞に対して放出する「レジオネラエフェクター」という多くのタンパク質群が必須であり,レジオネラエフェクターはIV型分泌装置であるDot/Icm装置を介して分泌される34).これまでの国内外の研究により多くのレジオネラエフェクーが同定されその機能が報告されてきたが,レジオネラエフェクターの歴史は2001年にRalFと呼ばれるレジオネラエフェクターが発見されたところから始まる.イエール大学のRoy博士らは野生型のレジオネラを含むLCV上でみられるArf1(細胞内小胞輸送に重要や役割を果たすGTPase)のリクルートがDot/Icm装置破壊株(dotA変異株)ではみられなくなることを見いだし35),何らかのレジオネラエフェクターがArf1のリクルートに必要であると考えた.宿主細胞において,Arfタンパク質の局在化や活性化に重要な役割を果たす因子としてグアニンヌクレオチド交換因子(GEF)があり,この因子には生物種間(酵母から哺乳類)においてSec7ドメインという保存された領域が存在している35).そこで,Roy博士らはデータベース検索を行い,Sec7と高い相同性を持つレジオネラエフェクターとしてRalFを見いだした35).そして,RalF遺伝子破壊株を含むLCV上にArf1が集積しないことやRalFはArf1に対するGEF活性を有することを明らかにし35),宿主細胞の生理機能を制御するレジオネラエフェクターの世界初の発見として報告した.そして,レジオネラエフェクターを中心とした研究が飛躍的に発展する.感染初期のLCVにER小胞がリクルートされることは前記したが,その過程においてレジオネラはLCV上にRab1(宿主細胞でER小胞をERGICやゴルジ体に繋留するGTPase)をリクルートしその機能を利用しており36),DrrA(別名SidM)がLCV上におけるRab1のGEFとして同定されている37).また,DrrAにはRab1にAMPを付加する活性(AMPylation活性)があり,AMPが付加したRab1はGTPからGDPへの加水分解が抑制されるので,結果的に活性化状態を維持できることになる38).その後,レジオネラはSidDを用いてRab1からAMPを除去し,LepBを介してGTPからGDPへと加水分解することでRab1をLCV上から解離させていることが明らかになっている39, 40).さらに,AnkXと呼ばれるレジオネラエフェクターはRab1やRab35(リサイクリング経路に関与)にホスホコリンを付加することで,その機能を負に制御することも明らかとなっている41).このように,レジオネラはレジオネラエフェクターを使い分けることによりきわめて巧妙に宿主小胞輸送機構を制御しているが,レジオネラエフェクターの制御する宿主生理機能は小胞輸送にとどまらず,オートファジー・アポトーシス・小胞体ストレス応答といった宿主防御機構にまで及ぶ.とりわけ,レジオネラはきわめてスマートな戦略を用いてオートファジーを制御する.
オートファジーは栄養飢餓時の栄養補填のみならず細胞内寄生菌の排除にも重要な役割を担っていることから,レジオネラとオートファジーの関連を解析する研究は精力的に行われてきた.しかしながら,「レジオネラはオートファジーを抑制する」といった報告が出てくる一方,「レジオネラは細胞内増殖のためにオートファジーを利用する」といった報告も出てくるなど,レジオネラとオートファジーの関連性は混沌とした状態であった.しかし,2011年にRoy博士らがRavZを発見したことにより,レジオネラがオートファジーを抑制することが決定的になった.ユビキチン様タンパク質であるAtg8はオートファゴソームへと局在化し,オートファゴソームの膜成分の供給や基質の取り込みを仲介する役割を担っている42).通常,Atg8は細胞質に局在しているが,オートファジーが惹起されるとAtg7(E1)とAtg3(E2)に渡されることで,そのC末端領域にあるグリシン残基にホスファチジルエタノールアミン(PE)が付加される43).PE化されたAtg8はオートファゴソームへと局在しその役割を発揮できる43).その後,システインプロテアーゼであるAtg4の活性により脱PE化されることによりAtg8は再利用される44).このAtg8のサイクルの過程において,システインプロテアーゼであるRavZはPE化したAtg8を特異的に認識し,PE化されるグリシン残基の上流を切断することで不可逆的にAtg8の機能を抑制する45).
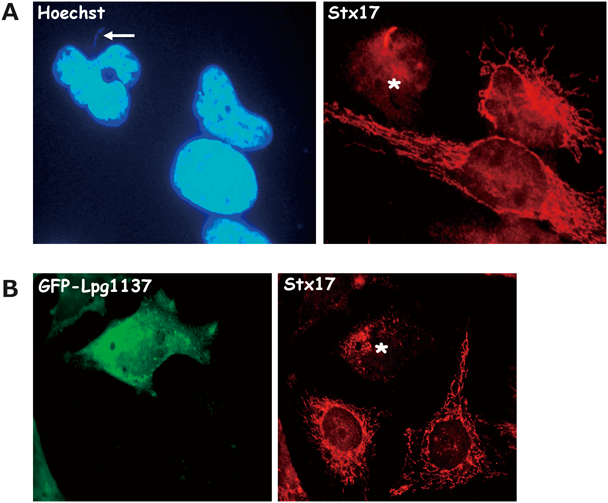
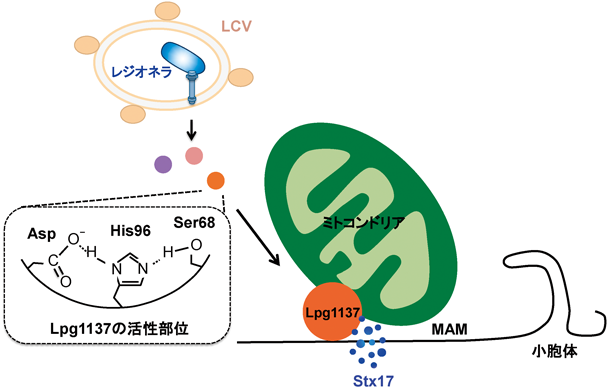
近年,MAMはウイルスや細菌感染の足場となっていることが明らかになりつつあり,レジオネラは小胞体内で増殖する細胞内発症型細菌である.それゆえ,筆者らはMAMにおいてミトコンドリア分裂やオートファジーなど種々の生理機能のプラットホームとして働くStx17がレジオネラ感染に何らかの機能を担っていると考えた.そこで,レジオネラ感染がStx17の局在や機能に与える影響を観察したところ,驚くべきことに,レジオネラが感染している細胞においてStx17が分解されていることを見いだした(図6A).また,この分解はレジオネラエフェクターが放出できないdotA変異株のレジオネラ感染ではみられないことから,何らかのレジオネラエフェクターがStx17の分解を担っていることが予測できる.そこで,Stx17を分解するレジオネラエフェクターの探索に着手し,本探索において強力なツールとなったのがisland欠損レジオネラ変異株である.宿主細胞に放出されるレジオネラエフェクターをコードする多くの遺伝子は,レジオネラゲノム上においてクラスター様の七つのislandにまとまって存在している46).タフツ大学のIsberg博士らはレジオネラ増殖に必要な二つのislandを除く五つすべてのisland(island名:2ab, 3, 4a, 6a, 7a)を欠損させた変異株(pentuple変異体)および各々のislandを欠損させた変異体を樹立している46).一つのislandにはおおむね15~30個のレジオネラエフェクターがコードされており,Stx17の分解が抑制されるisland欠損株があれば迅速かつ容易に責任分子を同定できる.これら変異株を用いた感染実験よりisland 2abの欠損株においてStx17の分解が抑制されていることを明らかにした.Island 2abには17種のレジオネラエフェクターがコードされていることから,各々のタンパク質を発現させた細胞を解析することによりStx17の分解をつかさどるレジオネラエフェクターが同定できることが期待される.解析の結果,17種のレジオネラエフェクターのうちLpg1137を発現している細胞においてのみStx17の分解が検出された(図6B).さらに,Lpg1137のORF内にトランスポゾンを挿入し転写を阻害したレジオネラ変異体(Lpg1137 TM)やLpg1137のノックアウトレジオネラ株の感染ではStx17の分解が抑制されることから,Lpg1137をStx17の分解に必須な因子として決定した.それでは,Lpg1137がどのような分子機構によりStx17を分解しているのか? また,Stx17を分解する生理的意義は何なのか?
細胞内における主なタンパク質分解機構としては,プロテアソームによる分解とプロテアーゼによる分解がある.そこで,各々の分解系の阻害がLpg1137によるStx17の分解に与える影響を評価した.MG132(プロテアソーム阻害剤)処理ではLpg1137によるStx17の分解への影響はみられなかった.一方,PMSF(セリンプロテアーゼ阻害剤)で処理を行った細胞ではStx17の分解が顕著に抑制されていることから,Lpg1137はStx17に対するセリンプロテアーゼであることが推測された.セリンプロテアーゼの活性中心に位置するセリン残基の周辺はGly-X-Ser-X-Gly/Alaのモチーフにより保存されていることが多く47),Lpg1137の配列内にもこのモチーフに相当するセリン残基が2か所存在している(68番目と134番目).これらセリン残基の変異体を作製し,Stx17の分解に対する影響を調べたところ,68番目のセリン変異体(S68A)においてStx17分解活性が著しく低下していた.さらに,精製タンパク質を用いた解析によりLpg1137がStx17を直接的に分解していること,Lpg1137がMAMにも豊富に存在していることを明らかにした.これらの結果は,Lpg1137がMAMに局在するStx17を認識し,プロテアーゼ活性により分解していることを示している(図7).このことは,MAMに局在できないStx17 K254変異体はLpg1137と結合せず,また分解からも逃れていることからも示された.
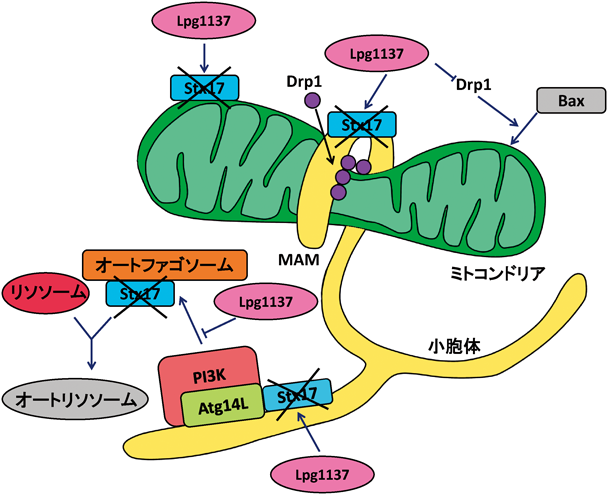
レジオネラがRavZを用いてオートファジーを阻害することは前途したが45),RavZを欠損させた変異株を感染させた細胞においてオートファジー活性は抑制されたままである45).すわなち,レジオネラはRavZ以外にもオートファジーを抑制するレジオネラエフェクターを保有していることを意味している.事実,sphingosine-1-phosphate lyase(LpSpI)と呼ばれるレジオネラエフェクターもオートファジーを抑制していることが報告された48).Stx17はオートファジーにおいて重要な因子であることから,Lpg1137によるStx17の分解がオートファジーに与える影響を評価した.野生型のLpg1137を発現している細胞では飢餓誘導に伴うLC3(酵母Atg8の哺乳類ホモログ)の脂質化およびpuncta形成が著しく抑制された一方,S68A変異体の発現ではこの抑制効果はみられなかった.さらに,野生型のLpg1137はAtg14LやDFCP1のpuncta形成も抑制していることから,Lpg1137はStx17を分解することにより隔離膜形成の段階から阻害していることが明らかとなった.よって,レジオネラはRavZ・LpSpI・Lpg1137の三つのレジオネラエフェクターを利用することで多角的にオートファジーを抑制していることになるが,Lpg1137がStx17を分解する生理的意義はオートファジー抑制のみなのか?
筆者らは,栄養条件におけるStx17の役割としてミトコンドリアの分裂制御を見いだしている.それゆえ,レジオネラがStx17を分解することにより本機能を阻害することが,レジオネラ感染に何らかのメリットをもたらすことが考えられる.そこで注目した現象がアポトーシスである.アポトーシスはウイルス・病原菌感染と密接に関わっており,感染細胞の防衛システムとしての最後の砦が病原菌を巻き込んだ自死である.しかしながら,レジオネラが感染した細胞はアポトーシスへの抵抗性を示すことが明らかになっている49).アポトーシスの促進には複数の経路が存在しているが,その中でも代表的なものがミトコンドリアからのチトクロムc放出を介したカスパーゼカスケードの活性化である50).この経路ではBaxと呼ばれるタンパク質が重要な役割を担っており,アポトーシスの刺激に伴いBaxはサイトゾルからミトコンドリア外膜へリクルートされた後にオリゴマー化することでミトコンドリア外膜にポアを形成しチトクロムcの放出を促す51).
また,Baxのミトコンドリア外膜へのリクルートにおいて,Baxはミトコンドリアの分裂部位(すなわちMAM)にDrp1の活性依存的にリクルートされることが近年の研究により明らかとなっている52).そこで,Lpg1137の発現がBaxにより仲介されるアポトーシスに与える影響を解析した.スタウロスポリン(STS)はBax依存的なアポトーシスを惹起する薬剤であり,細胞をSTSにより刺激すると(I)染色体の凝集,(II)細胞質へのチトクロムc放出(III)切断型(活性化型)カスパーゼ3の出現といったアポトーシスを示すインデックスが増加する.しかしながら,Lpg1137を発現している細胞ではSTS処理を行ってもこれらインデックスの増加は検出されなかった.一方,Lpg1137 S68A変異体の発現細胞にSTS処理を行った場合,コントロールの細胞と同じレベルでのインデックス上昇が認められた.また,Lpg1137 TMを感染させた細胞では野生型のレジオネラ感染でみられるアポトーシス抵抗性が有意に低下していることからも,Lpg1137はStx17を分解することによりオートファジーに加えてアポトーシスも阻害していることが推測される(図8).このことは,Stx17にはオートファジーやミトコンドリア分裂制御に加えてアポトーシス促進活性もあることを示しており,事実,Stx17を発現抑制した細胞はSTSにより誘導されるアポトーシスに対して強い抵抗性を示すようになる.さらに,STS刺激により促進されるBaxのミトコンドリア分裂部位へのリクルートがStx17の発現抑制により著しく抑制されていた.レジオネラ感染細胞がアポトーシスに抵抗性を示すことは前途しているが49),そこに関わるレジオネラエフェクターや具体的な分子機構は不明であった.筆者らの本研究はレジオネラによるアポトーシス抑制機構およびStx17のアポトーシスへの関与という新たな機能を明らかにした点において重要な研究であると考えており,2017年のNature Communicationsで報告した53).
筆者らは,オートファジー関連SNAREタンパク質として報告されたStx17のオートファジー以外の役割を見いだすところから本研究に着手し,Stx17の栄養条件における局在やミトコンドリアの分裂制御への役割を発見した30).さらに,レジオネラがLpg1137を用いてStx17を分解することで,オートファジーのみならずアポトーシスも抑制していることを見いだし,レジオネラ感染を通じてStx17の新しい機能の発見に成功した53).しかしながら,解決しなくてはならない課題が引き続き残されている.Stx17は栄養状態に応じてDrp1もしくはAtg14Lと結合することにより,ミトコンドリア分裂やオートファゴソーム形成に働くが,栄養状態に依存した結合パートナーの変換がどのような分子機構により仲介されているのかを明らかにすることはStx17の機能を理解する上できわめて重要となる.筆者らはStx17と結合するタンパク質の網羅的解析を行い,微小管関連タンパク質であるMAP1B-LC1(LC1)を候補分子として同定している.興味深いことに,LC1を発現抑制すると栄養条件にも関わらずオートファゴソーム形成が促進される(Stx17とAtg14Lとの相互作用も促進)一方,LC1の過剰発現は飢餓条件でのオートファゴソーム形成を阻害する.また,飢餓誘導に伴いStx17はLC1から解離することも見いだしており,栄養状態におけるStx17の役割はLC1との相互作用によって制御されている可能性が示唆されている.現在,この可能性を実証する解析を行っている.
Lpg1137においては,局在化の分子機構を明らかにすることが重要であると考えている.Lpg1137を発現した細胞を用いて分画を行うと,Lpg1137はMAM画分に豊富に検出される53).ここで大切なポイントは「Stx17はLpg1137の発現により分解されている」ということである.もし,Lpg1137がStx17との結合を介してMAMなどに局在しているとしたらStx17の分解後は細胞質に分散すると考えられる.しかし,Stx17の分解後もLpg1137はMAMにとどまっていることから,Lpg1137にはMAMを標的化できるドメインが存在している可能性が考えられる.
多くのレジオネラエフェクターは,脂質結合ドメインを介して標的膜へと局在化していることが明らかになっている54).よって,今後はLpg1137と親和性のある脂質の同定を試みる.なお,MAM脂質に対するよいバイオプローブは存在しておらず,もしMAMを標的化できるLpg1137の脂質結合領域を同定できればMAMに対する新規バイオプローブへの応用も期待される.