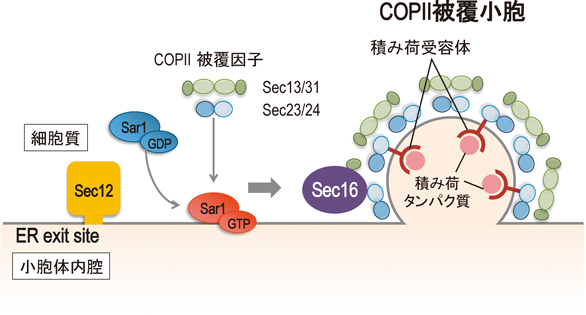
COPII被覆小胞の構成因子群は,出芽酵母における遺伝学的スクリーニングによって単離された5).さらに,その後の生化学的な解析によってCOPII被覆小胞形成の順序が明らかになってきた6, 7).
COPII被覆小胞は低分子量Gタンパク質であるSar1と,内側被覆因子Sec23/Sec24,および外側被覆因子であるSec13/Sec31によって構成されている.COPII被覆小胞の形成は,Sar1がグアニンヌクレオチド交換因子(GEF)であるSec12によってGTP結合型に活性化されることにより開始される8, 9).活性化したSar1はSec23/Sec24および積み荷タンパク質とprebudding complexを形成する7, 10, 11).その後Sec23/Sec24にSec13/Sec31が結合すると,Sec23のSar1に対するGTPase促進活性(GAP活性)が増大し,Sar1がGDP型へと変換され,小胞が形成される(図1)12–14).
まずは,COPII小胞の形成に関与する個々の因子について,これまでに解明されている機能について概説する.
1)Sar1
Sar1は出芽酵母において温度感受性Sec12変異体のmulticopy suppressorとして単離された,Arfファミリーに属する低分子量Gタンパク質である15).出芽酵母ではSar1は1種類のみであるが,脊椎動物にはSar1AとSar1Bの二つのアイソフォームが存在する16).
Sar1の活性化はCOPII被覆小胞の形成に必要であるが,その役割については議論の余地が残されている.in vitroの再構成系によって,Sar1の活性化とそれに伴うGTPの加水分解反応により小胞の出芽が促されることが示されてきた2, 12, 17, 18).しかしながら,小胞の出芽過程にSar1によるGTPの加水分解が必ずしも必要ではないという報告もいくつか存在する19).さらにSar1の活性化と不活性化のサイクルは,小胞形成に応じて1回回転するわけではなく,Sar1のGTPサイクルが幾度も回ることで,積み荷分子のCOPII小胞への濃縮が起こることが明らかになってきた20, 21).また合成リポソームを用いた生化学的な解析によって,Sar1が活性化に伴い構造変化し,N末端の親水性ヘリックスを小胞体膜に挿入することで,膜の曲率を変化させることが示されている22–24).さらに小胞の形成に伴う膜の曲率の増大は,Sar1の膜への親和性を高くし,Sar1の加水分解活性をさらに上昇させることが明らかとなった25).このことは,小胞形成時にSar1の加水分解サイクルにポジティブフィードバック機構が存在することを示唆している.以上のように,Sar1は小胞形成時に多様な機能を示すことが明らかとなっている.
2)Sec12
Sec12は出芽酵母における遺伝学的スクリーニングによって同定された因子であり,細胞質側にWD40モチーフを持つII型膜タンパク質である5, 26).その後の解析により,Sec12はSar1に対するグアニンヌクレオチド交換因子(GEF)として機能することが明らかとなった9).また最近の構造解析により,カリウムイオンがWD40モチーフ部分へ配位することが,適切なGEF活性のために重要であることが明らかになった27).
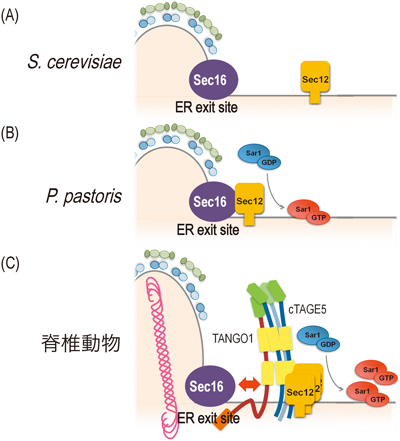
Sec12は出芽酵母Saccharomyces cerevisiaeにおいては小胞体膜に拡散して存在するが28, 29),同じく出芽酵母であるPichia pastorisでは,Sec16との結合依存的にER exit siteに局在化する30, 31).哺乳細胞においては,Sec12が小胞体全体に拡散して存在すると報告されていたが32),筆者らによる検討の結果,少なくとも一部のSec12はcTAGE5との結合を介して,ER exit siteに濃縮して存在することが明らかになっている33).
哺乳細胞のSec12にはPREB(prolactin regulatory element binding protein)という別名が存在する.これは,Sec12(PREB)が当初,ホルモンであるプロラクチンの発現を制御するDNA結合タンパク質として単離された経緯があるためである34).転写因子としての活性と小胞体からの分泌の制御との関係性は未解明であり,今後の解析が期待される.
3)Sec23/Sec24
Sec23はSec24と複合体を形成してCOPII小胞の内側被覆因子として働く35).Sec24は膜貫通型の積み荷と直接結合するか,あるいは膜貫通型の積み荷受容体を介して積み荷タンパク質をリクルートすることで,COPII被覆小胞に濃縮させる役割を担っている.哺乳細胞では4種類のSec24アイソフォーム(Sec24A, Sec24B, Sec24C, Sec24D)が知られており,それぞれ異なった種類の積み荷,あるいは積み荷受容体と結合し,これらを選別する機能を有していると考えられる36–38).また一つのSec24分子内に複数の積み荷結合ドメインが存在することも,多様な積み荷の分泌に寄与していると考えられる.
一方で,Sec23はSar1に対するGTP加水分解促進因子(GAP)としても働く14).さらにSec23のGAP活性は,Sec13/Sec31がSec23/Sec24と結合することによって大きく上昇する12, 13).
4)Sec16
Sec16は,COPII被覆小胞の形成に必要な因子の一つとして単離され,出芽酵母からヒトに至るまで高度に保存されている6, 39–42).Sec16はER exit siteにおいてCOPIIタンパク質群の多くと結合することから,小胞形成の際に足場タンパク質として機能すると考えられてきた30, 43–48).また,ハエや哺乳細胞では,Sec16の発現抑制時にCOPIIタンパク質群がER exit siteに局在化しなくなることから,Sec16はER exit siteのオーガナイザーとしても働く可能性が考えられている.しかし,出芽酵母の一種であるP. pastorisでは,Sec16はSec23依存的にER exit siteに局在化することが知られている49).したがって,Sec16の機能は,生物種によって異なる可能性が考えられる.
さらにSec16はSec24と相互作用し,Sec13/Sec31の結合を阻害することによって,Sar1のGTPase活性を負に調節することが報告されている50, 51).
高等真核生物においては,コラーゲンやキロミクロンのように通常の輸送小胞の大きさを超える分子が分泌される.このうちゴルジ体間のコラーゲン輸送は,ゴルジ体の槽成熟(cisternae maturation)によって担われるために,巨大分子自体は輸送小胞に入り込む必要がないと考えられている52, 53).一方で,小胞体からゴルジ体への巨大分子の分泌は,COPIIタンパク質に依存して担われることは報告されているものの,どのようなメカニズムによって輸送されるのか,10年ほど前までほとんどわかっていなかった3).
電子顕微鏡による解析から,コラーゲンがER exit site近くの小胞体から伸びる突起状の膜構造の中に存在するようすが観察された54).また,最近の超解像顕微鏡を用いた解析により,コラーゲンを含む巨大な小胞の存在が明らかになった55).これらの知見から,コラーゲンは巨大なCOPII被覆小胞によって運ばれる可能性が示されてきた.
では,巨大COPII小胞はどのようにして形成されるのか.興味深いことに,Sar1の活性化型(GTP固定型)変異体(Sar1H79G)をセミインタクト細胞に注入すると小胞体からチューブが形成されることが明らかとなっている56).この現象は人工リポソームに対し,Sar1の活性化型変異体,あるいはGTPの非加水分解アナログであるGTPγSやGMP–PNPをSar1とともに添加した際にも観察されている12, 17, 18, 23).さらにZanettiらのグループは,単層の巨大リポソームにSar1活性型とCOPII被覆タンパク質を添加すると,COPII被覆に覆われたチューブが形成されることをクライオ電子顕微鏡によって明らかにした57).また,Sec23/Sec24に覆われたチューブ状の構造は,同じくSec23/Sec24に覆われた球状の構造よりもSec13/31の結合量が減る可能性が推察されている.このことは,チューブ状の構造の方が球状の構造に比べてSar1の活性化型をより安定的に保持しやすい(つまりSar1の加水分解活性が低い)可能性を提示している.すなわち,Sar1のGTPase活性の制御がCOPII胞の大きさの制御に重要であることを強く示唆している.実際に,我々はSar1のGTPase活性の制御がコラーゲンの分泌に非常に重要であることを明らかにしている58).このことについては,後の節で詳しく解説する.
Sar1Bは脊椎動物に保存されたSar1のアイソフォームであるが,Sar1Bのヌクレオチド結合領域の変異が,キロミクロン停滞病やAnderson病といったキロミクロンの分泌障害を表現型とする遺伝性疾患で見つかっている59).さらにSar1Bをモルフォリノで発現抑制したゼブラフィッシュやメダカにおいても同様の表現型がみられた60).以上のことは,Sar1Bが巨大分子の分泌に重要な役割を担っていることを強く示唆している.Sar1AとSar1Bのアミノ酸配列の相同性は非常に高く,Sar1Bが小腸や肝臓などのキロミクロンやVLDLの分泌される場所で優位に発現していることから,Sar1AとSar1Bの発現部位の違いが要因となって,Sar1Bが特異的にキロミクロンの輸送に関与する可能性が考えられている.またSar1Bを発現抑制するとSrebp2の小胞体からの出芽が特異的に抑制されることも知られている61).さらに,in vitroにおいて膜の硬さを測定したところ,Sar1Bによって形成されるCOPII被覆は,Sar1Aによるものと比較して,より柔らかいといった報告も存在する62).以上のように,Sar1B特異的なキロミクロンの輸送メカニズムに関してはさまざまな知見が報告されてきているが,統合的な理解のためには,さらなる解析が必要である.
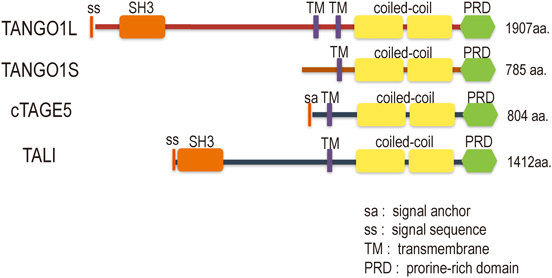
1)TANGO1
ショウジョウバエS2細胞を用いたゲノムワイドなsiRNAスクリーニングによって,小胞体からゴルジ体への輸送に必要なタンパク質を複数同定し,TANGO遺伝子群(transport and Golgi organization)と命名した63).この中でも,特にTANGO1と命名した因子は,コラーゲンの分泌に特異的に関与することを明らかにした(図2)64).哺乳細胞においてTANGO1遺伝子は,選択的スプライシングによってTANGO1LとTANGO1Sと呼ばれる2種類のタンパク質を生成する.TANGO1LとTANGO1SのC末端は相同であるが,TANGO1LはTANGO1Sと比べ長いN末端にSH3ドメインを有している(図2)65).
TANGO1LとTANGO1Sの共通C末端領域は細胞質に配向し,TANGO1Lの長いN末端領域は小胞体内腔に配向する.TANGO1LのN末端のSH3ドメインは,直接あるいは,コラーゲン特異的シャペロンであるHSP47を介してコラーゲン分子と結合する64, 66).
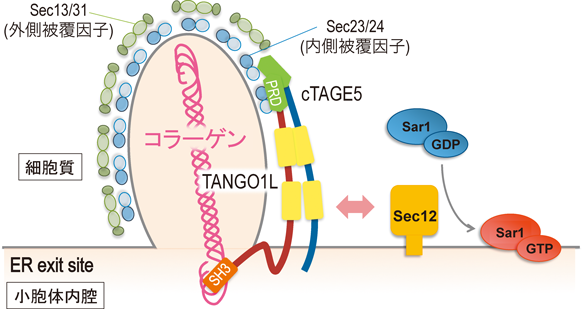
またTANGO1L, TANGO1Sは両者とも,C末端の共通領域に存在するプロリンリッチ領域(PRD)でSec23/Sec24と結合する64, 67).TANGO1とSec23/Sec24との結合は,Sec13/Sec31による小胞の完成を阻害することによって,巨大なCOPII小胞の形成に関与する可能性が考えられている(図3)4, 67, 68).
以上のことからTANGO1Lはコラーゲンの積み荷受容体として働く可能性が明らかとなった.このことは,TANGO1Lのノックアウトマウスが重篤なコラーゲン分泌不全によって出生後すぐに致死になることからも強く支持されている69).
興味深いことに,コラーゲン認識ドメインを持たないTANGO1SもTANGO1Lと同様にコラーゲンの分泌に必要である65).これは,TANGO1SがcTAGE5との結合を介してSec12をER exit siteに集積することが,コラーゲン分泌に重要であるためと考えられる33, 70).さらにTANGO1はSNARE依存的な融合に関与するSec1/Munc18ファミリーの分子であるsly1と相互作用すること,この相互作用によってERGIC膜がER exit siteと融合することによって巨大COPII小胞の形成が行われるというモデルも報告されている71, 72).
2)cTAGE5
cTAGE5はもともと腫瘍マーカーとして発見された因子であるが,TANGO1Sと非常によく似たドメイン構造を有している(図2).我々は,cTAGE5とTANGO1が2番目のcoiled-coilドメインで直接相互作用することを見いだし,TANGO1とともにコラーゲン分泌に関与することを明らかにした73).さらに,cTAGE5は膜貫通領域近傍の細胞質側領域でSec12と直接相互作用したが,TANGO1とSec12は相互作用しなかった(図3).cTAGE5とSec12の結合はSec12のSar1に対するGEF活性を変化させなかったが,cTAGE5を発現抑制するとSec12がER全体に拡散することから,cTAGE5とSec12の結合はSec12のER exit siteへの局在化に必須であることが明らかとなった33).さらにcTAGE5のSec12結合ドメインを同定し,Sec12と結合できないcTAGE5点変異体を作製した.cTAGE5をノックダウンした細胞においては,コラーゲン分泌は阻害されるが,cTAGE5を発現させることでコラーゲン分泌は回復した.一方でSec12と結合できないcTAGE5を発現させても,コラーゲン分泌は阻害されたままであった.興味深いことに,Sec12と結合できないcTAGE5変異体に加えてSar1野生型を過剰発現させることによって,コラーゲン分泌は回復したが,Sar1の活性化型変異体を発現させても,コラーゲン分泌は阻害されたままであった70).以上の結果から,cTAGE5によるSec12のER exit siteへの集積はSar1の活性化を介してコラーゲン分泌に必要であること,またコラーゲン分泌にはSar1のGTPサイクルが回転することが必要であることが再確認された(図3)4, 58).
3)TANGO1/cTAGE5/Sec12複合体
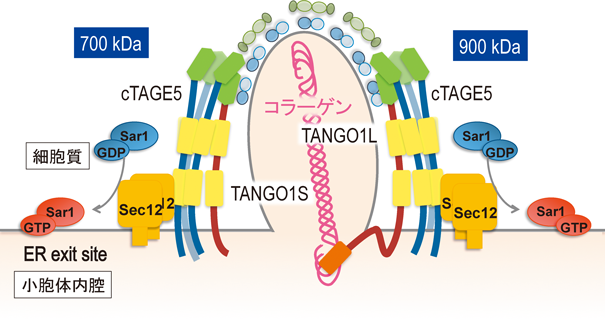
TANGO1, cTAGE5,およびSec12がそれぞれ相互作用することから,複合体を形成している可能性について検証した.このためBlue-Native PAGEとSDS-PAGEを組み合わせた二次元電気泳動による解析を行った.この結果,TANGO1L, cTAGE5, Sec12は約900 kDaの複合体を形成すること,TANGO1S, cTAGE5, Sec12は約700 kDaの複合体を形成することが明らかとなった(図4).さらなる解析の結果,cTAGE5はホモ多量体を形成し,それぞれにSec12が結合することが明らかとなった.これにより,一つのTANGO 1分子につき,cTAGE5を介して複数のSec12分子が結合することで効率よくSar1の活性化が起こる可能性が考えられた65).この複合体構成と,最近報告されたTANGO1のER exit siteにおけるRing状の構造体との関連性は今後注目すべき点である74, 75).
4)キロミクロンの輸送
最近の研究からcTAGE5が肝・腎などの限定された組織において選択的スプライシングにより,TANGO1L様の長いアイソフォームTALI(TANGO1-like)として発現することが明らかとなった76, 77).TALIおよびTANGO1はApoBを介してキロミクロンと結合し,キロミクロンの小胞体からの分泌に関与する可能性が示唆された.さらに最近,線虫の卵黄タンパク質の輸送にSFT-4が関与することが示された78).卵黄タンパク質はリポタンパク質であり,哺乳動物におけるキロミクロンにあたる.事実,哺乳細胞においてSFT-4のヒトホモログであるSurf4がキロミクロンの輸送に関与することが示された78).Surf4, TANGO1, TALIがどのように機能することにより,キロミクロンの輸送が達成されるのか今後の成果が注目される.
1)KLHL12, Sec31
CUL3-KLHL12がSec31をモノユビキチン化することによって,コラーゲンを内包できるような巨大な小胞の形成が促されることが報告された79).またカルシウム結合タンパク質であるPEF1とALG2がCUL3-KLHL12とSec31をつなぐアダプターとして機能する可能性が明らかになった80).さらに最近,USP8によるSec31の脱ユビキチン化が巨大小胞の形成を抑制する可能性が示唆されている81).KLHL12, Sec31による巨大小胞形成機構とTANGO1複合体との関連が今後注目される.
2)Sedlin
Sedlin(TRAPPC2)はTRAPP複合体の構成因子の一つであるが,spondyloepiphyseal dysplasia tarda(SEDT)と呼ばれる遺伝病の原因遺伝子としても知られている.SEDTはX染色体に連鎖した骨障害で,低身長と関節の変形を特徴とする82).SedlinはTANGO1と活性化型のSar1の両者に結合することが報告されており,Sedlinの発現抑制によってER exit siteに活性化型のSar1が蓄積し,コラーゲン分泌が阻害されることから,SedlinがSar1の不活性化過程に関与する可能性が考えられている83).
3)TFG
TFGはER exit siteに局在化し,ホモ六量体を形成しSec16およびSec23と相互作用することで小胞体からERGICに至るCOPII小胞どうしを連携する役割を担っていると考えられている84–86).最近,TFGがコラーゲンの分泌にも関与することが示唆されており,今後の解析が期待される87).
TANGO1Sの分泌に対する影響を明らかにするためにTANGO1LとTANGO1Sの両者をノックダウンした細胞におけるVSVG-GFPの分泌を観察した.結果,TANGO1LおよびTANGO1Sの両者を発現抑制した細胞において,VSVG-GFPの分泌が遅延した.さらに,Sec16とSec31の共局在率が低下した.このことから,TANGO1LとTANGO1Sの発現抑制によって,機能的なER exit siteの数が減少した結果,通常の積み荷であるVSVG-GFPの輸送が遅延したと考えられた.実際,両者を発現抑制した細胞にTANGO1Sのみを発現させることで,Sec16とSec31の共局在率は回復した.さらにTANGO1にSec16が直接結合すること,結合ドメインがSec16のELD(ER localization domain)であることを明らかにした.Sec16はER exit siteのオーガナイザーとして考えられているが,膜貫通タンパク質ではないために,その機能の発揮のためには,まずはER膜上に局在化しなければならない.以上の結果は,Sec16がTANGO1との結合依存的にER exit siteに局在化する可能性を示唆している.
これを検証するために,Sec16との結合に必要なTANGO1のドメイン(C末端のプロリンリッチ領域)をミトコンドリアへ異所性に局在を変化させた.その結果,Sec16がミトコンドリアへと局在を移行した.つまり,TANGO1はSec16のER exit siteへの局在化に必須であることが強く示唆された.
一方でSec16を発現抑制した細胞においてはTANGO1がER exit siteへ局在化できず,小胞体全体に拡散した.以上の結果から,TANGO1とSec16は協調してER exit siteの局在制御に関与する可能性が考えられた.さらにcTAGE5およびSec12はTANGO1との結合依存的にER exit siteへ局在化した.つまり,TANGO1とSec16は協調してER exit siteのオーガナイザーとして機能することが明らかとなった88).
前述のように,出芽酵母S. cerevisiaeにおいては,Sec16はSec23との結合依存的にER exit siteへ局在化し,Sec12は小胞体膜上を拡散して存在する(図5).一方で,同じく出芽酵母であるP.pastorisにおいては,Sec16はSec23との結合依存的にER exit siteへ局在するが,Sec12はSec16と直接結合することによってER exit siteへリクルートされる(図5).今回の研究より,哺乳細胞においては,Sec16はTANGO1との結合を介してER exit siteへの局在化し,さらにTANGO1はcTAGE5, Sec12と巨大複合体を形成する.このため,1分子のSec16が多分子のSec12をER exit siteへリクルートすることが可能であり,このSar1の効率的な活性化が巨大分子の分泌を含む高等真核生物の複雑な分泌を可能にしていると考えられる(図5).
一方で,TANGO1を最初に単離したショウジョウバエにおいては,TANGO1Lのみが存在し,TANGO1SやcTAGE5の存在は確認されていない.最近,ショウジョウバエにおけるTANGO1のノックダウンがコラーゲンのみならず,通常のタンパク質分泌も阻害することが報告された.さらに,ショウジョウバエにおいてもTANGO1がER exit siteのオーガナイザーとして機能する可能性が提示されている89, 90).よってショウジョウバエにおいて,TANGO1がSec12をER exit siteへリクルートする機能を有しているかが興味深いところである.