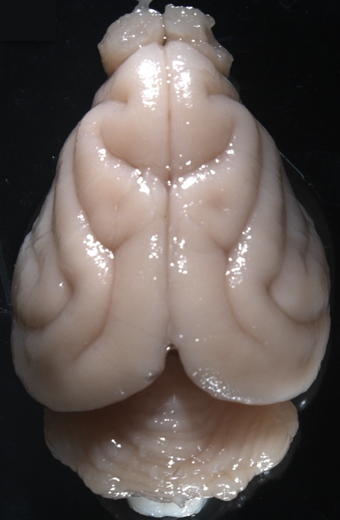
大脳皮質のシワは3次元的な立体構築であり,急峻な陥凹(脳溝)によって区切られた大脳皮質の隆起(脳回)により特徴的なシワ状の外観を呈する(図1).シワは進化的に哺乳動物でのみみられ,シワを持つ大脳をgyrencephalic,持たない大脳をlissencephalicと表現する.lissencephalicな大脳では大脳皮質の外表面は平滑であり,新皮質と進化的に古い梨状皮質とを分ける嗅脳溝(rhinal fissure)以外はシワを持たない.大脳皮質のシワは一般的に,ウシ,サル,ヒト,ゾウ,クジラなどの大きな大脳を持つ動物種にはみられるのに対して,ラットやマウスなどの大脳が小さい動物種はシワを持たないことが多い.
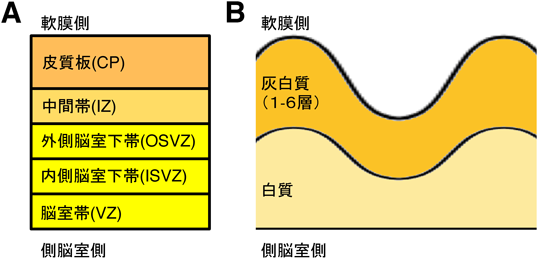
大脳皮質は外側(1層)から内側(6層)まで順に配列された六つの主要なニューロン層(灰白質)と,軸索の束を含む白質から構成される.シワを持たない動物種の大脳の断面をみると灰白質が平坦で厚さがほぼ一定である.対照的にシワを持つ動物種の大脳においては灰白質が折りたたまれ,軟膜側の大脳皮質外表が弯曲のある構造を呈している(図3B).灰白質の六つの層はすべて弯曲している一方で,白質は6層との境界でのみ弯曲に対応し,白質の側脳室側は平滑であり弯曲はみられない.したがって,白質は脳溝部分よりも脳回部分においてより厚くなっている(図3B).
最終的には複雑に折りたたまれるシワだが,発生過程では早期に深い溝である一次脳溝が作られ,その後に二次脳溝,三次脳溝の順に作られていく.ヒトよりも単純なシワのパターンを有する動物(たとえば,フェレット)では一次脳溝のみが発達しており,一次脳溝の位置は異なる動物個体間で強く保存され一定である1).このように異なる動物個体間でもシワの位置が一定であるということは,シワの形成過程が遺伝的に規定されていることを示唆している.二次脳溝の位置は必ずしも一定ではなく,さらに高次な脳溝の位置はランダムにみえることから,遺伝的な影響は限定的であると考えられている.ただし,遺伝的に同一である一卵性双生児間のシワのパターンは,高次脳溝を含めても,一般的な集団よりも統計的に類似性が高い2).まとめると,大脳皮質の一次脳溝のパターンは遺伝的な要因により規定されており,高次脳溝になれば遺伝的要因の関与は少ないと考えられる.
大脳が持つさまざまな構造的特徴から,シワの形成メカニズムが推測されてきた.まず第一に,サイズが大きい大脳を持つ動物種ではシワがみられるが,大脳が小さい動物種ではみられないことから1),神経細胞などが多く産生されることがシワ形成に重要である可能性が提示された.すなわち,限られた頭蓋内容積のなかで大脳皮質が拡大していくために,物理的な圧が生じて,大脳皮質にシワが生じると推測された.しかし,頭蓋内の圧を軽減してもシワの消失にはつながらなかったことから,この可能性は低いと考えられている3).第二に,シワが存在する大脳では大脳皮質形成期に,神経前駆細胞層である脳室帯(ventricular zone:VZ)と内側脳室下帯(inner subventricular zone:ISVZ)の外側に,さらに追加で特徴的な組織学的構築を持つ神経前駆細胞層,外側脳室下帯(outer subventricular zone:OSVZ)が存在することが多い(図3A)4).マーモセットなどいくつかの動物種のように,シワがほとんどないにもかかわらずOSVZを持つ例外も存在するが5),OSVZにみられる神経前駆細胞の存在量はシワ形成指数と正の相関を示す6).したがって,OSVZがシワ形成に重要である可能性が考えられる.それと関連して第三に,大脳皮質のシワ形成は神経前駆細胞であるOSVZ radial glia(oRG)の存在量とも関連がみられる.oRGは,三つの研究室によって独立して同定された新たな神経前駆細胞で6–8),outer radial gliaなどとも呼ばれる9).シワを持つ動物種のOSVZに主に存在し,シワを持たない動物の大脳皮質にはあまり存在しないことから,シワとの関連が注目されている.第四に,齧歯類におけるSVZとは異なり,シワを持つ動物のISVZおよびOSVZでは神経前駆細胞の形態および遺伝子発現が多様であることから,この多様性もシワ形成に重要である可能性がある10–13).最後に,シワ形成は神経前駆細胞の細胞分裂の頻度6)および遺伝子発現パターン12, 14, 15)とも関連がみられている.これらのいずれが真にシワ形成に重要か解明が待たれているが,これまでは大脳にシワを持つ動物での遺伝子操作が困難であったために,シワ形成の分子メカニズムの解析はほとんど進んでこなかった.
4. マウスを用いたシワの形成メカニズムへのアプローチ
マウスの大脳にはシワは存在しないが,分子遺伝学的研究にきわめて有用であることから,マウスを用いてシワ形成メカニズムを明らかにする試みもなされてきた.神経前駆細胞を過剰増殖させると,脳回に類似する弯曲を大脳皮質の外表面(軟膜側)に作ることができた16).しかしこの実験では,生理的にシワを持つ動物ではみられないような脳室側の異常もみられたことから16),本来の生理的なシワとは異なる弯曲ではないかと指摘されている.また胎生期の細胞死を抑制してもマウスの大脳皮質にシワが生じるが,やはり生理的なシワではみられないような異常が出現しており,生理的なシワとは異なる可能性が高い17–19).
その他にもマウスの大脳皮質にシワを作る試みがなされている.マウス大脳皮質における核タンパク質Trnp1の阻害20),Shhシグナリングの活性化21),類人猿特異的遺伝子ARHGAP11B22)やTBC1D323)の過剰発現は神経前駆細胞の増加を引き起こし,マウスの大脳皮質にシワを生じさせる.これらの初期の試みは,胎仔期の大脳皮質の神経前駆細胞を操作することによりマウス大脳皮質に弯曲を作れることを実験的に実証した点で重要であるが,シワを持つ動物種でみられるような本来のシワ形成にこれらの分子が関与しているか詳細な検証が必要である.
シワ形成メカニズムの解明を飛躍的に促進するために,フェレットを用いた研究が注目されている.大脳皮質にシワを持つ食肉類哺乳動物であるフェレットは他の動物種に比べて以下のような有利な点があるからである.第一に,フェレットのシワのパターンには動物個体間の差がほとんどなく,ほぼ同一である点があげられる.したがって,安定した実験結果が得られることが期待できる.第二に,シワの形成が,新生仔の出生後に始まることがあげられる24).したがって,シワの形成プロセスを解析する際に胎仔を使用する必要がない.第三に,飼育しやすい動物であり,欧米を中心に神経科学研究に用いられてきた歴史があることから25–27),飼育に関するノウハウがある.第四に,脳神経系以外にもインフルエンザウイルス,麻疹ウイルスなどの感染症研究,嘔吐がみられるために嘔吐機構研究や薬剤副作用の研究にも用いられており,実験動物として認知されている.これらの特徴のためにフェレットではシワ形成メカニズムを明らかにするための研究が行いやすい.平均体長は約50 cmで体重は1~2 kg,平均寿命は6~8年といわれている.野生動物ではなく,ヨーロッパケナガイタチが家畜化したものではないかといわれている.
上述の利点がありながらも,フェレットの脳神経系を用いた分子生物学的技術が整っていなかったために,フェレットを用いた脳研究はごく一部の研究にとどまっていた.そこで我々はフェレットに分子生物学的技術を導入できれば脳回研究の突破口となると考え,研究を進めてきた25–27).まず,遺伝子の同定を行うためにフェレット用マイクロアレイを作製し,高等哺乳動物で発達している視覚神経系の大細胞や小細胞に選択的に発現する遺伝子を同定してきた28–30).続いて,齧歯類を中心に行われていた子宮内エレクトロポレーション法を高等哺乳動物に応用することに初めて成功し,フェレット大脳皮質への遺伝子導入に成功した(図4)31–33).RGやoRGなどの神経前駆細胞や,大脳皮質のほぼすべての層へも効率よく遺伝子導入が可能となった.エレクトロポレーションを用いているため実験後数日という短時間で遺伝子発現を誘導することができ,また複数種類のプラスミドを容易に共導入できる.我々はさらにゲノム編集技術であるCRISPR/Cas9と子宮内エレクトロポレーション法を組み合わせることにより,マウスやフェレット脳内での簡便な遺伝子ノックアウト技術を確立した34–36).これらのフェレットを用いた分子生物学的解析基盤の整備の結果,フェレットを用いたシワ形成機構の解析が可能となった25–27).
これらの技術を用いてシワ形成における神経前駆細胞の役割が解析された.胎生期の一時期にVZからOSVZの神経前駆細胞が出現する.この神経前駆細胞の分裂期に,薬剤を用いてフェレット大脳皮質の細胞分裂を抑制すると,シワの形成も抑制された37).逆にフェレット大脳皮質で神経前駆細胞の細胞分裂を促進すると脳回が増加した38, 39).また脳回形成期以前のフェレット大脳皮質の解析結果,大脳皮質の位置によって細胞分裂量が異なることがわかった.この細胞増殖量は脳回の位置と対応しており,脳回となる領域には多く存在し,脳溝となる領域では少なかった6).したがって神経前駆細胞の細胞分裂がシワ形成において重要な要因であることが示唆された.ただし,重要なことにシワを持たないマウス胎仔の大脳皮質で,フェレットに用いた手法と同様な手法で神経前駆細胞の増殖を促進してもシワは生じてこなかった38).したがって,動物種ごとのシワの有無を規定する要因は,神経前駆細胞の細胞分裂以外にも存在すると考えられる.おもしろいことに,活性化型β-カテニンを用いてマウス大脳皮質で神経前駆細胞の増殖を促進するとシワが形成されたとの報告がある16).マウス大脳皮質では神経前駆細胞増殖の促進によりシワが形成される場合とされない場合があることが示唆され,どのような違いがシワの有無を規定するか興味深い.
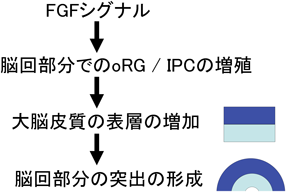
神経前駆細胞にはVZに存在する放射状グリア(radial glia:RG),ISVZもしくはOSVZに存在するoRGおよび中間前駆細胞(IPC)の3種類が存在する.このいずれの神経前駆細胞がシワ形成に重要か検討するために,我々はフェレット大脳皮質におけるPax6およびTbr2の発現分布を解析した.その結果,oRGおよびIPCの分布に偏りがあり,oRGおよびIPCは将来,脳回になる部分に多く存在し,脳溝になる部分には少ないことがわかった12, 14).oRGやIPCの脳回形成における重要性を検討するために,フェレット大脳皮質へ子宮内エレクトロポレーションを用いてIPCに選択的に発現する転写因子Tbr2の優性不能型(正常な内在性Tbr2の機能を阻害する変異体)を発現させた14).その結果,RGには影響がなかったがoRGとIPCが減少し,脳回形成が抑制されることを見いだした14).この結果はoRGもしくはIPCが脳回形成に重要であることを初めて実験的に示したものである.oRGもしくはIPCが脳回を作る部分に多く分布し,細胞を多く供給することで脳回という隆起を作る可能性が考えられる(図5).
発達期大脳皮質におけるマウスとフェレットの相違点の一つは,ISVZやOSVZの神経前駆細胞の組成の違いである.シワを持つ動物種,すなわちヒト,サルやフェレットではOSVZおよびISVZにPax6陽性,Tbr2陰性のoRGが多く存在する7, 10, 11).この観察から,oRGが多いことがシワ形成に重要である可能性が考えられている40).ただし現在のところ,oRGもしくはIPCのいずれか一方のみの選択的な細胞数の操作はできておらず,oRGおよびIPCのシワ形成における機能的重要性は実験的に区別できていない.今後の重要な研究課題であろう.
シワ形成メカニズムの分子レベルからの解明も進みつつある.発達期のフェレット大脳皮質を用いて,将来的に脳回になる部位および脳溝になる部位の細胞増殖層のトランスクリプトーム解析が行われた12).これらの二つの部位間で発現量に差がみられた遺伝子の発現分布を詳細に検討すると,不均一な発現パターンは主にOSVZにおいてみられ,脳回および脳溝が形成される領域と一致していたことから,シワ形成を制御している可能性がある12).この不均一な発現パターンは脳回を持たないマウスの大脳皮質ではみられなかった.また,このような発現パターンを示す遺伝子の多くは,大脳皮質形成に異常を示すヒト患者で変異がみられることから,シワ形成を制御する重要な要因であることが示唆された.
そこで我々は,実際にシワ形成に重要な役割を担っている遺伝子を同定するために,フェレットへの子宮内エレクトロポレーションを用いてシワ形成メカニズムの解析を行った.IPCに多く発現する転写因子Tbr2の優性不能型を導入したところ,oRGおよびIPCが減少し,さらに脳回形成が抑制された.この結果はTbr2が脳回形成に必須であることを示している14).
優性不能型Tbr2を発現させシワ形成が抑制された大脳皮質を詳細に検討すると,6層のうちの表層側の厚さが選択的に減少し,深層側はあまり影響を受けていないことを見いだした14).この結果は過去に提示されたシワ形成に関する仮説のなかで,シワの形成には大脳皮質の表層側と深層側の量比が重要であるとの仮説に一致していた41, 42).この仮説を検証するために,リン酸化酵素Cdk5に着目した研究を行った.Cdk5はヒトの滑脳症の原因遺伝子であることから43),シワ形成に重要であると想定されていた.我々はフェレットの大脳皮質でCRISPR/Cas9を用いてCdk5のノックアウトを行いシワ形成が障害されることを見いだし,実際にCdk5がシワ形成に重要であることを実験的に証明した35).続いて,大脳皮質のどの層のCdk5が重要であるかを検討した.大脳皮質深層もしくは表層に優性不能型Cdk5を導入したところ,表層側に導入した場合にのみシワ形成が障害された35).脳神経系ではCdk5は他のCdk遺伝子とは異なり細胞増殖ではなく,大脳皮質神経細胞の放射状移動に重要であることが知られている.したがってこれらの結果は,大脳皮質の表層側に神経細胞が供給され,表層側が厚くなることが脳回形成に重要であるとの仮説を支持している(図5).
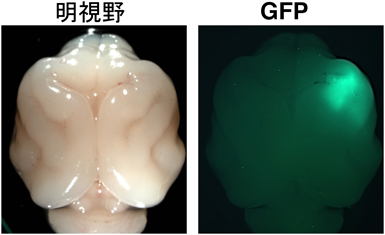
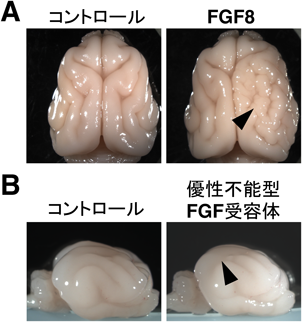
上述のように,oRGもしくはIPCなどの神経前駆細胞の細胞分裂がシワ形成に重要であることがわかった.次の重要な点は,これらの細胞分裂の分子制御機構である.この分子機構の手がかりも脳回形成異常疾患から得られた.タナトフォリック骨異形成症は骨形成異常と多小脳回症やヘテロトピアなどの脳形成異常を伴う先天性疾患であるが,その原因としてFGF受容体3(FGFR3)の活性化型変異が報告されていた44).そこで我々は,FGFシグナルがシワ形成に関わる可能性があると考えた.FGFR3のリガンドであるFGF8をフェレット大脳皮質に導入したところシワの数が増加し,多小脳回症およびヘテロトピアを再現することに成功した(図6)39, 45, 46).この結果は,FGFシグナルの活性化がシワ形成に十分であることを示唆している.続いて,FGFシグナル活性化がシワ形成に必要であるかを検討した.優性不能型FGF受容体をフェレット大脳皮質へ導入したところ,シワ形成が抑制されることを見いだした(図6)15).さらにFGF活性により,oRGやIPCの細胞分裂と細胞数が制御されていたことから15, 39),FGFがSVZ神経前駆細胞の細胞分裂を制御する上流因子であることが明らかとなった(図5).
上述のようにシワ形成を制御する分子機構は明らかになりつつあるが,説明できない面も残されている.たとえば,遺伝的に同一である一卵性双生児においてもシワのパターンは完全に同一ではない2).フェレットなどの動物が持つ一次脳溝は遺伝学的に規定されているが,高次脳溝についてはまったく異なるメカニズムが働いている可能性がある.たとえば,生体力学的な力,すなわち局所的な圧力もしくは張力が,遺伝的に規定された基本的なシワの上に,さらにシワを追加するのかもしれない47, 48).
脳回の特徴の一つは,最も小さい脳回の幅がどのような動物種においても大差がないことがあげられる.このことは,大脳皮質が屈曲する際に物理的な制約が存在することを示唆している.物理的制約の一つは大脳皮質の厚さが考えられる.多くの細胞が積み重なった厚い大脳皮質は,薄い皮質よりも曲がるために大きな屈曲を必要とすると考えられる49).この仮説は最近数理モデル化され検証が進められているが50),まだ一般的に受け入れられるところまでは至っていない51).
大脳皮質のシワは長くにわたり研究者の関心を引き続けているが,その形成機構は謎であった.フェレットのような適切な動物モデルの使用,さらに遺伝子操作技術の発達により,近年,脳回形成の分子メカニズムが急速に明らかになりつつある.今後,この分野に関する知見は指数関数的に増えることが期待される.従来はマウスをモデル動物として使用することによりヒトの発達,機能,および疾患の理解が進んできたが,今後はフェレットなどの新しいモデル系を使用することで,脳回以外でもヒトの脳でみられる複雑な脳構築や機能,その異常による疾患病態の理解が進むと考えられる.
引用文献References
1) Welker, W.(1990) In: Jones, E.G., & Peters, A., editors. Cerebral Cortex, 8B. Boston, MA: Springer. p. 3–136.
2) Lohmann, G., von Cramon, D.Y., & Steinmetz, H. (1999) Sulcal variability of twins. Cereb. Cortex, 9, 754–763.
3) Borrell, V. (2018) How cells fold the cerebral cortex. J. Neurosci., 38, 776–783.
4) Smart, I.H., Dehay, C., Giroud, P., Berland, M., & Kennedy, H. (2002) Unique morphological features of the proliferative zones and postmitotic compartments of the neural epithelium giving rise to striate and extrastriate cortex in the monkey. Cereb. Cortex, 12, 37–53.
5) Kelava, I., Reillo, I., Murayama, A.Y., Kalinka, A.T., Stenzel, D., Tomancak, P., Matsuzaki, F., Lebrand, C., Sasaki, E., Schwamborn, J.C., et al. (2012) Abundant occurrence of basal radial glia in the subventricular zone of embryonic neocortex of a lissencephalic primate, the common marmoset Callithrix jacchus. Cereb. Cortex, 22, 469–481.
6) Reillo, I., de Juan Romero, C., Garcia-Cabezas, M.A., & Borrell, V. (2011) A role for intermediate radial glia in the tangential expansion of the mammalian cerebral cortex. Cereb. Cortex, 21, 1674–1694.
7) Fietz, S.A., Kelava, I., Vogt, J., Wilsch-Brauninger, M., Stenzel, D., Fish, J.L., Corbeil, D., Riehn, A., Distler, W., Nitsch, R., et al. (2010) OSVZ progenitors of human and ferret neocortex are epithelial-like and expand by integrin signaling. Nat. Neurosci., 13, 690–699.
8) Hansen, D.V., Lui, J.H., Parker, P.R., & Kriegstein, A.R. (2010) Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature, 464, 554–561.
9) Gertz, C.C., Lui, J.H., LaMonica, B.E., Wang, X., & Kriegstein, A.R. (2014) Diverse behaviors of outer radial glia in developing ferret and human cortex. J. Neurosci., 34, 2559–2570.
10) Betizeau, M., Cortay, V., Patti, D., Pfister, S., Gautier, E., Bellemin-Menard, A., Afanassieff, M., Huissoud, C., Douglas, R.J., Kennedy, H., et al. (2013) Precursor diversity and complexity of lineage relationships in the outer subventricular zone of the primate. Neuron, 80, 442–457.
11) Reillo, I. & Borrell, V. (2012) Germinal zones in the developing cerebral cortex of ferret:ontogeny, cell cycle kinetics, and diversity of progenitors. Cereb. Cortex, 22, 2039–2054.
12) de Juan Romero, C., Bruder, C., Tomasello, U., Sanz-Anquela, J.M., & Borrell, V. (2015) Discrete domains of gene expression in germinal layers distinguish the development of gyrencephaly. EMBO J., 34, 1859–1874.
13) Johnson, M.B., Wang, P.P., Atabay, K.D., Murphy, E.A., Doan, R.N., Hecht, J.L., & Walsh, C.A. (2015) Single-cell analysis reveals transcriptional heterogeneity of neural progenitors in human cortex. Nat. Neurosci., 18, 637–646.
14) Toda, T., Shinmyo, Y., Dinh Duong, T.A., Masuda, K., & Kawasaki, H. (2016) An essential role of SVZ progenitors in cortical folding in gyrencephalic mammals. Sci. Rep., 6, 29578.
15) Matsumoto, N., Shinmyo, Y., Ichikawa, Y., & Kawasaki, H. (2017) Gyrification of the cerebral cortex requires FGF signaling in the mammalian brain. eLife, 6, e29285.
16) Chenn, A. & Walsh, C.A. (2002) Regulation of cerebral cortical size by control of cell cycle exit in neural precursors. Science, 297, 365–369.
17) Kingsbury, M.A., Rehen, S.K., Contos, J.J., Higgins, C.M., & Chun, J. (2003) Non-proliferative effects of lysophosphatidic acid enhance cortical growth and folding. Nat. Neurosci., 6, 1292–1299.
18) Haydar, T.F., Kuan, C.Y., Flavell, R.A., & Rakic, P. (1999) The role of cell death in regulating the size and shape of the mammalian forebrain. Cereb. Cortex, 9, 621–626.
19) Depaepe, V., Suarez-Gonzalez, N., Dufour, A., Passante, L., Gorski, J.A., Jones, K.R., Ledent, C., & Vanderhaeghen, P. (2005) Ephrin signalling controls brain size by regulating apoptosis of neural progenitors. Nature, 435, 1244–1250.
20) Stahl, R., Walcher, T., De Juan Romero, C., Pilz, G.A., Cappello, S., Irmler, M., Sanz-Aquela, J.M., Beckers, J., Blum, R., Borrell, V., et al. (2013) Trnp1 regulates expansion and folding of the mammalian cerebral cortex by control of radial glial fate. Cell, 153, 535–549.
21) Wang, L., Hou, S., & Han, Y.G. (2016) Hedgehog signaling promotes basal progenitor expansion and the growth and folding of the neocortex. Nat. Neurosci., 19, 888–896.
22) Florio, M., Albert, M., Taverna, E., Namba, T., Brandl, H., Lewitus, E., Haffner, C., Sykes, A., Wong, F.K., Peters, J., et al. (2015) Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science, 347, 1465–1470.
23) Ju, X.C., Hou, Q.Q., Sheng, A.L., Wu, K.Y., Zhou, Y., Jin, Y., Wen, T., Yang, Z., Wang, X., & Luo, Z.G. (2016) The hominoid-specific gene TBC1D3 promotes generation of basal neural progenitors and induces cortical folding in mice. eLife, 5, 5.
24) Smart, I.H. & McSherry, G.M. (1986) Gyrus formation in the cerebral cortex in the ferret. I. Description of the external changes. J. Anat., 146, 141–152.
25) Kawasaki, H. (2014) Molecular investigations of the brain of higher mammals using gyrencephalic carnivore ferrets. Neurosci. Res., 86, 59–65.
26) Kawasaki, H. (2017) Molecular investigations of development and diseases of the brain of higher mammals using the ferret. Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci., 93, 259–269.
27) Shinmyo, Y., Masuda, K., Hoshiba, Y., Ebisu, H., & Kawasaki, H.(2017) In:Shigeno, S., Murakami, Y., & Nomura, T., editors. Brain Evolution by Design. New York:Springer Publishers. p. 311–327.
28) Kawasaki, H., Crowley, J.C., Livesey, F.J., & Katz, L.C. (2004) Molecular organization of the ferret visual thalamus. J. Neurosci., 24, 9962–9970.
29) Iwai, L., Ohashi, Y., van der List, D., Usrey, W.M., Miyashita, Y., & Kawasaki, H. (2013) FoxP2 is a parvocellular-specific transcription factor in the visual thalamus of monkeys and ferrets. Cereb. Cortex, 23, 2204–2212.
30) Sato, C., Iwai-Takekoshi, L., Ichikawa, Y., & Kawasaki, H. (2017) Cell type-specific expression of FoxP2 in the ferret and mouse retina. Neurosci. Res., 117, 1–13.
31) Kawasaki, H., Iwai, L., & Tanno, K. (2012) Rapid and efficient genetic manipulation of gyrencephalic carnivores using in utero electroporation. Mol. Brain, 5, 24.
32) Kawasaki, H., Toda, T., & Tanno, K. (2013) In vivo genetic manipulation of cortical progenitors in gyrencephalic carnivores using in utero electroporation. Biol. Open, 2, 95–100.
33) Kawasaki, H.(2015) In: Saito, T., editor. Electroporation Methods and Neuroscience. New York: Springer Publishers. p. 105–113.
34) Shinmyo, Y., Tanaka, S., Tsunoda, S., Hosomichi, K., Tajima, A., & Kawasaki, H. (2016) CRISPR/Cas9-mediated gene knockout in the mouse brain using in utero electroporation. Sci. Rep., 6, 20611.
35) Shinmyo, Y., Terashita, Y., Dinh Duong, T.A., Horiike, T., Kawasumi, M., Hosomichi, K., Tajima, A., & Kawasaki, H. (2017) Folding of the cerebral cortex requires Cdk5 in upper-layer neurons in gyrencephalic mammals. Cell Reports, 20, 2131–2143.
36) Shinmyo, Y. & Kawasaki, H. (2017) CRISPR/Cas9-mediated gene knockout in the mouse brain using in utero electroporation. Curr. Protoc. Neurosci., 79, 3 32 31–33 32 11.
37) Haddad, R., Rabe, A., & Dumas, R. (1979) Neuroteratogenicity of methylazoxymethanol acetate:behavioral deficits of ferrets with transplacentally induced lissencephaly. Neurotoxicology, 1, 171–189.
38) Nonaka-Kinoshita, M., Reillo, I., Artegiani, B., Martinez-Martinez, M.A., Nelson, M., Borrell, V., & Calegari, F. (2013) Regulation of cerebral cortex size and folding by expansion of basal progenitors. EMBO J., 32, 1817–1828.
39) Masuda, K., Toda, T., Shinmyo, Y., Ebisu, H., Hoshiba, Y., Wakimoto, M., Ichikawa, Y., & Kawasaki, H. (2015) Pathophysiological analyses of cortical malformation using gyrencephalic mammals. Sci. Rep., 5, 15370.
40) Borrell, V. & Gotz, M. (2014) Role of radial glial cells in cerebral cortex folding. Curr. Opin. Neurobiol., 27, 39–46.
41) Richman, D.P., Stewart, R.M., Hutchinson, J.W., & Caviness, V.S. Jr. (1975) Mechanical model of brain convolutional development. Science, 189, 18–21.
42) Kriegstein, A., Noctor, S., & Martinez-Cerdeno, V. (2006) Patterns of neural stem and progenitor cell division may underlie evolutionary cortical expansion. Nat. Rev. Neurosci., 7, 883–890.
43) Magen, D., Ofir, A., Berger, L., Goldsher, D., Eran, A., Katib, N., Nijem, Y., Vlodavsky, E., Tzur, S., Behar, D.M., et al. (2015) Autosomal recessive lissencephaly with cerebellar hypoplasia is associated with a loss-of-function mutation in CDK5. Hum. Genet., 134, 305–314.
44) Shiang, R., Thompson, L.M., Zhu, Y.Z., Church, D.M., Fielder, T.J., Bocian, M., Winokur, S.T., & Wasmuth, J.J. (1994) Mutations in the transmembrane domain of FGFR3 cause the most common genetic form of dwarfism, achondroplasia. Cell, 78, 335–342.
45) Matsumoto, N., Hoshiba, Y., Morita, K., Uda, N., Hirota, M., Minamikawa, M., Ebisu, H., Shinmyo, Y., & Kawasaki, H. (2017) Pathophysiological analyses of periventricular nodular heterotopia using gyrencephalic mammals. Hum. Mol. Genet., 26, 1173–1181.
46) Matsumoto, N., Kobayashi, N., Uda, N., Hirota, M., & Kawasaki, H. (2018) Pathophysiological analyses of leptomeningeal heterotopia using gyrencephalic mammals. Hum. Mol. Genet., 27, 985–991.
47) Van Essen, D.C. (1997) A tension-based theory of morphogenesis and compact wiring in the central nervous system. Nature, 385, 313–318.
48) Hilgetag, C.C. & Barbas, H. (2006) Role of mechanical factors in the morphology of the primate cerebral cortex. PLOS Comput. Biol., 2, e22.
49) Zilles, K., Palomero-Gallagher, N., & Amunts, K. (2013) Development of cortical folding during evolution and ontogeny. Trends Neurosci., 36, 275–284.
50) Mota, B. & Herculano-Houzel, S. (2015) BRAIN STRUCTURE. Cortical folding scales universally with surface area and thickness, not number of neurons. Science, 349, 74–77.
51) Lewitus, E., Kelava, I., Kalinka, A.T., Tomancak, P., & Huttner, W.B. (2016) Comment on “Cortical folding scales universally with surface area and thickness, not number of neurons”. Science, 351, 825.