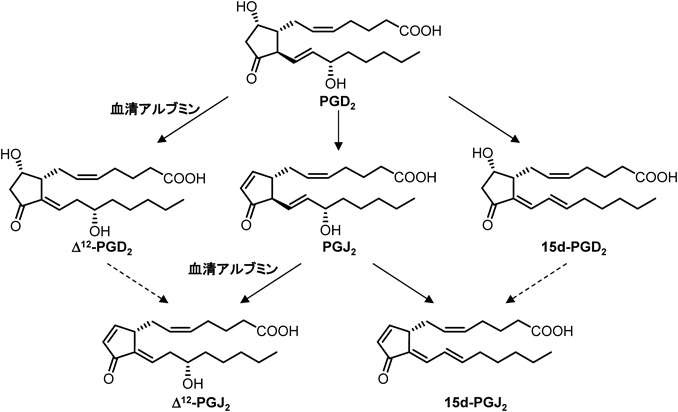
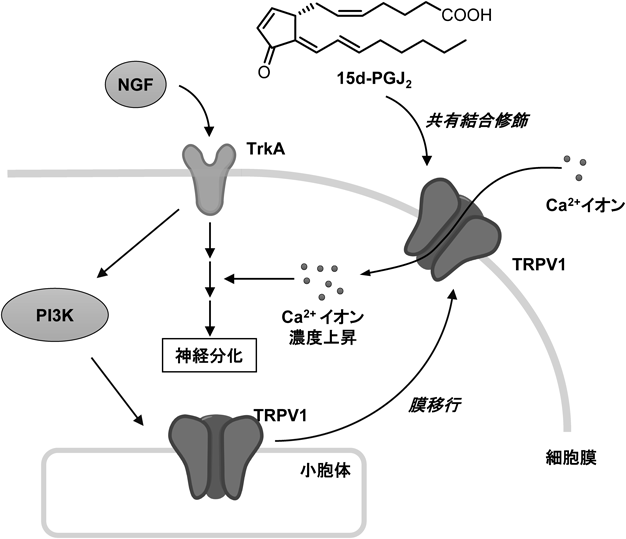
プロスタグランジンD2代謝物に関する最近の話題Current topics in prostaglandin D2 metabolites
1 名古屋大学大学院生命農学研究科応用生命科学専攻食品機能化学研究室Laboratory of Food and Biodynamics, Graduate School of Bioagricultural Sciences, Nagoya University ◇ 464–8601 愛知県名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya, Aichi 464–8601
2 東京大学大学院農学生命科学研究科応用生命化学専攻食糧化学研究室Laboratory of Food Chemistry, Department of Applied Biological Chemistry, Graduate School of Agricultural and Life Sciences, The University of Tokyo ◇ 〒113–8657東京都文京区弥生1–1–1 ◇ 1–1–1 Yayoi, Bunkyo-ku, Tokyo 113–8657