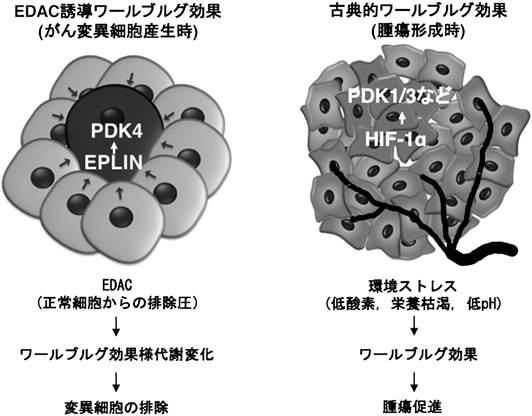
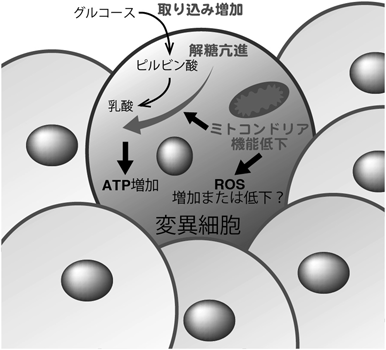
ワールブルグ効果様代謝変化による抗腫瘍機能An anti-tumorigenic role of the Warburg effect-like metabolic shift
東京理科大学生命医科学研究所発生および老化研究部門Division of Development and Aging, Research Institute for Biomedical Sciences, Tokyo University of Science ◇ 〒278–0022 千葉県野田市山崎2669 ◇ 2669 Yamazaki, Noda-shi, Chiba 278–0022, Japan