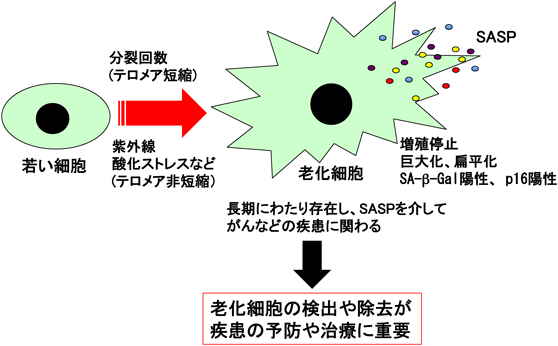
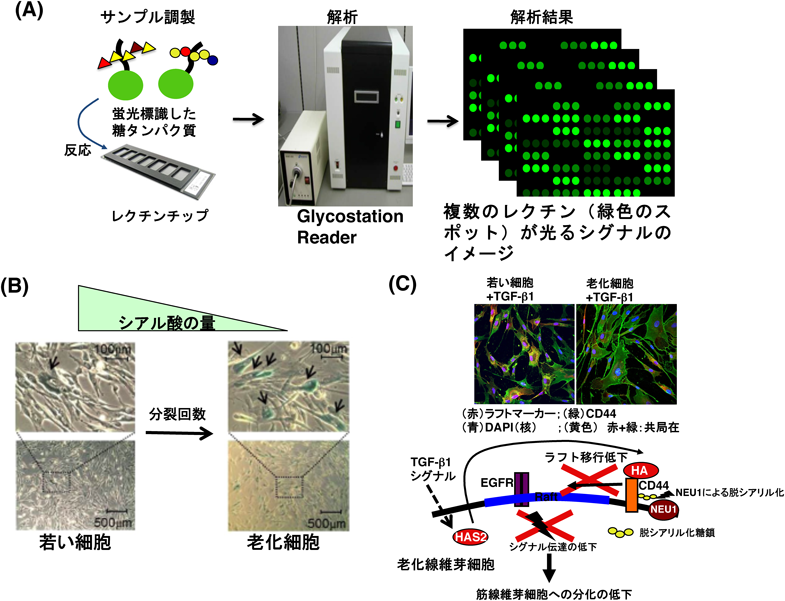
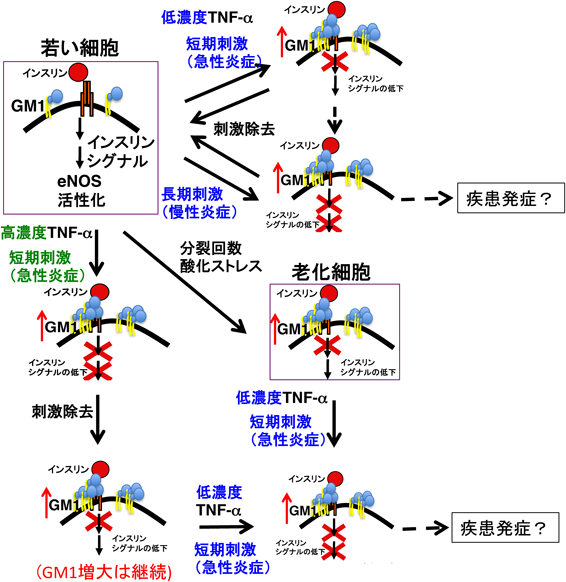
老化関連疾患の予防,治療法の開発に向けた「老化と糖鎖」Senescence and glycoconjugate research toward development of prevention and therapeutic method for senescence-associated diseases
東京都健康長寿医療センター研究所老年病態研究チームResearch Team for Geriatric Medicine, Tokyo Metropolitan Institute of Gerontology ◇ 〒173–0015 東京都板橋区栄町35–2 ◇ 35–2 Sakae-cho, Itabashi-ku, Tokyo 173–0015, Japan