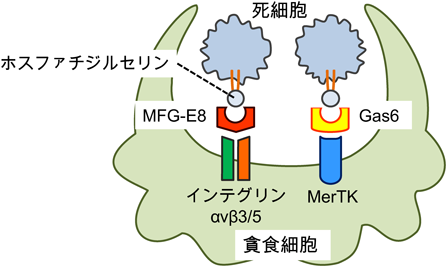
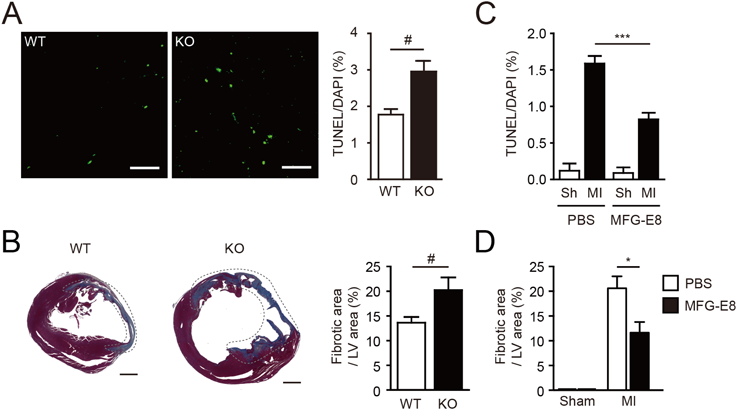
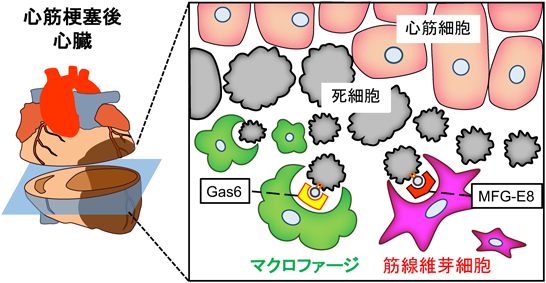
心筋梗塞時における死細胞貪食Engulfment of dead cells in myocardial infarction
九州大学大学院薬学研究院薬効安全性学分野Department of Pharmacology and Toxicology, Graduate School of Pharmaceutical Sciences, Kyushu University ◇ 〒812–8582 福岡県福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan