繊毛・鞭毛は,ゾウリムシからヒトまでの多くの真核生物が有する細胞膜から突出したオルガネラである.短いものは繊毛,長いものは鞭毛と一般に呼ばれているが,基本的な構造はどちらも同じである.また,繊毛の長さは1~5 µm,太さ約250 nmである.ヒトなどの動物ではほとんどの細胞(血球細胞以外の神経細胞や心筋細胞まで)に繊毛が形成される.
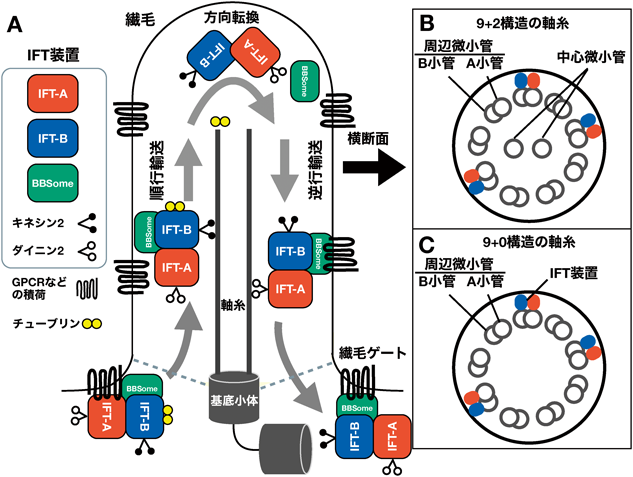
繊毛は,基底小体(中心体の母中心小体が特殊化した構造)から伸びた軸糸と繊毛膜からなる基本構造をとる(図1A).一般的なオルガネラとは異なり,繊毛の根元は膜によって仕切られてはいない.しかし,繊毛内部は,繊毛ゲート(ciliary gate)と呼ばれる構造[トランジション・ファイバー(transition fiber)とトランジション・ゾーン(transition zone)によって構成される]によって細胞質から隔離されている1).また,繊毛膜と細胞膜の脂質組成も異なり,細胞膜と比べると繊毛膜ではホスファチジルイノシトール4,5-二リン酸[PtdIns(4,5)P2]に対してホスファチジルイノシトール4-リン酸[PtdIns(4)P]がはるかに豊富に存在する2, 3).
繊毛は,運動性繊毛と非運動繊毛(一次繊毛)に大別される.運動性繊毛は9+2構造からなる軸糸(図1B)と自発的な運動性をもたらす軸糸ダイニンを有するのに対して,一次繊毛は9+0構造の軸糸(図1C)で軸糸ダイニンを持たず,運動しない(ただし,ノード繊毛のように9+0構造の軸糸を持つ繊毛であっても運動性を有する例外もある4)).運動性繊毛の代表例として,精子の鞭毛や,卵管や気道の上皮細胞の多繊毛がある.排卵された卵は卵管の繊毛上を転がって子宮に到達し,精子は鞭毛を動かして卵にまで到達して受精する.気道上皮細胞は,繊毛を波打たせてゴミを体外へと(痰として)掃き出す.
このように運動性繊毛の働きが明確なのに対して,一次繊毛の働きは長らく不明であった.一次繊毛の存在自体は100年以上も前に報告されていたが,機能を持たない痕跡器官のようなものとみなされ,研究がほとんどなされていなかった5).ところが2000年ごろになって,一次繊毛に関連する遺伝子の変異がさまざまな遺伝性疾患の原因であることが明らかになり,一次繊毛の重要性が再認識されるようになった6).これまでの研究によって,一次繊毛にはさまざまな受容体やイオンチャネル,アデニル酸シクラーゼなどが存在し,外部からのシグナル[機械的シグナルやヘッジホッグ(Hh)などの発生シグナル分子]を感知するアンテナのような働きをしていることがわかってきた.また,一次繊毛の形成や繊毛内タンパク質輸送の異常によって,多岐にわたる重篤な病態(嚢胞腎,網膜変性,骨形成異常,病的肥満,精神遅滞,内臓逆位,多指,不妊など)が引き起こされることも判明した.一次繊毛の異常に起因する遺伝性疾患には,Bardet-Biedl症候群(BBS),Joubert症候群(JBTS),Meckel症候群(MKS),ネフロン癆(NPHP),短肋骨性胸郭異形成(SRTD),頭蓋外胚葉異形成(CED)などがあり,これらは繊毛病と総称される7).
繊毛の形成と構造の維持のためには,必要なタンパク質を細胞質から繊毛内へと運び込み,繊毛内の適切な場所に届けなければならない.繊毛内タンパク質輸送(intraflagellar transport:IFT)を担うIFT装置は,1993年に単細胞緑藻のクラミドモナスの鞭毛で発見された8).Rosenbaumらのグループは,ビデオ顕微鏡と電子顕微鏡を用いた観察によって,クラミドモナスの鞭毛内で基部から先端に向かって動く粒子と,先端から基部へ向かう粒子が存在することを見いだした.彼らは,粒子が鞭毛内をシャトル運動するようすから,タンパク質を運んでいるに違いないと予想してIFT粒子と名づけた.発見当初はIFT粒子がタンパク質を運んでいるという証拠はなかったが,予想は見事に当たっていた.その後,クラミドモナスの変異体を使った遺伝学的な解析によって,IFT粒子がモータータンパク質のキネシン2とダイニン2によってそれぞれ順行方向と逆行方向に動いていることや,軸糸の形成に必要なチューブリンなどの積荷タンパク質を実際に運んでいることが明らかになった9–11).また,クラミドモナスの鞭毛から単離されたIFT粒子の生化学的解析によって,IFT粒子が多数のタンパク質からなる複合体であり,IFT-A複合体とIFT-B複合体の二つに分けられることが判明した12).さらに最近では,ライブイメージングと電子顕微鏡を組み合わせたクラミドモナスの鞭毛の観察によって,IFT装置は軸糸の周辺微小管のB小管上を順行輸送され,A小管上を逆行輸送されることが明らかになった13)(ただし,クラミドモナス以外の生物の繊毛にも当てはまるのかについては今後の検討が必要である).
2007年には,Nachuryらによって,IFT複合体と積荷タンパク質をつなぐアダプターとして機能するBBSome複合体が発見された14).BBSome複合体は,Bardet-Biedl症候群(BBS)の原因遺伝子によってコードされる八つのタンパク質からなる15).BBSome複合体がなくてもIFT装置自体の輸送は影響を受けないが,繊毛内に局在するGタンパク質共役受容体(GPCR)などの輸送が異常になる.
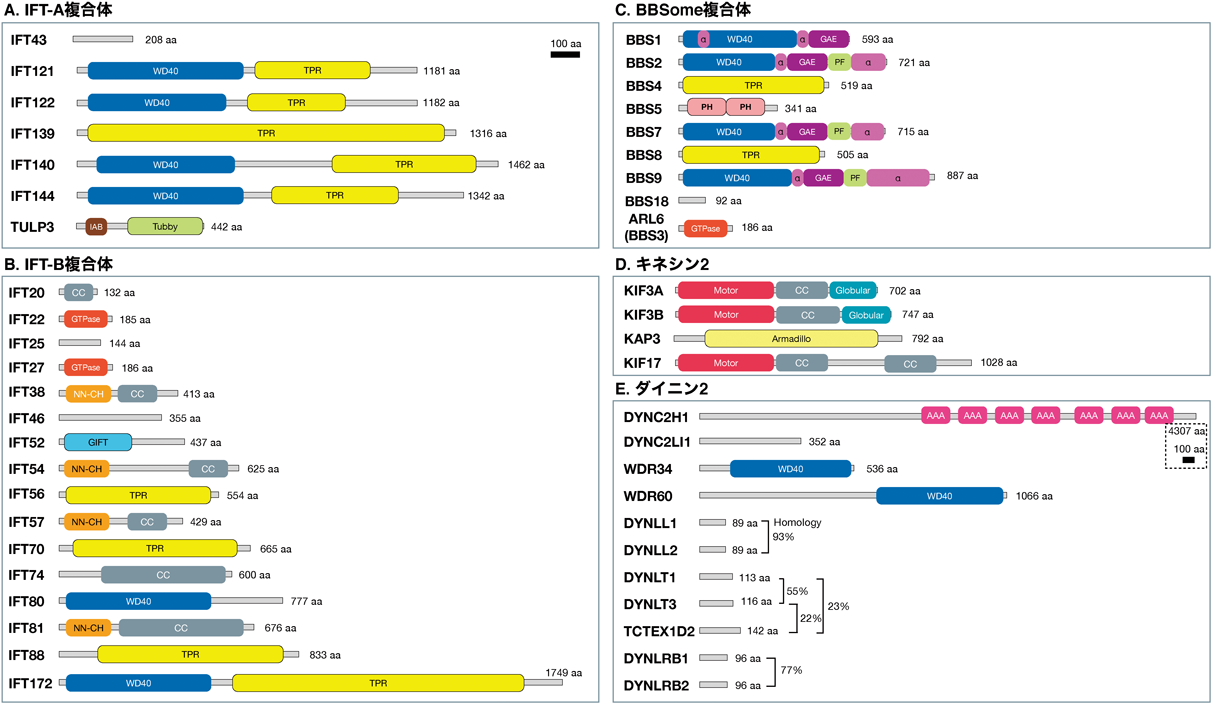
このようにして,IFT装置を構成するIFT-A複合体,IFT-B複合体,BBSome複合体,モータータンパク質のキネシン2およびダイニン2の五つの複合体が同定され,40種類以上のサブユニットがリストアップされていった(図2,表1).IFT装置を構成するタンパク質をコードする遺伝子は,進化的にかけ離れたクラミドモナスからヒトに至るまで繊毛を持つ生物において高度に保存されており,IFT装置の基本的な構成と機能は共通していると考えられる.ただし,細部については種によってさまざまな違いがあるので,IFT装置に関する総説や論文を読む際にはどの生物種で得られた結果なのかに注意する必要がある.本稿では,主にヒトやマウスなど哺乳類のIFT装置に関する最近の研究動向を,筆者らの研究を中心にして紹介したい16).
表1 IFT装置を構成するサブユニットの異常によって生じる表現型 | サブユニット名 | 別名 | 疾患名 | KO細胞の表現型(繊毛形成) | KO細胞の表現型(繊毛内タンパク質輸送) | 参考文献 |
|---|
| IFT-B複合体コア1サブ複合体 | IFT22 | RABL5 | | 正常 | 正常 | 24) |
| IFT25 | | | 正常 | 逆行輸送および繊毛からの排出の障害 | 51) |
| IFT27 | RABL4 | BBS19 | 正常 | 逆行輸送および繊毛からの排出の障害 | 52) , *1 |
| IFT74 | | | | | |
| IFT81 | | | | | |
| コア2サブ複合体 | IFT46 | | | | | |
| IFT52 | | | | | |
| IFT56 | TTC26 | | 正常 | KIF17の繊毛先端局在の障害 | 55) |
| IFT70A/B | TTC30A/B | | 繊毛形成不全 | | 24) |
| IFT88 | | | 繊毛形成不全 | | 40) |
| ペリフェラルサブ複合体 | IFT20 | | | 繊毛形成不全 | | 40) |
| IFT38 | CLUAP1 | | 繊毛形成不全 | | 44) , *1 |
| IFT54 | TRAF3IP1 | | 繊毛形成不全 | | 78) , *1 |
| IFT57 | | | 繊毛形成不全 | | 79) |
| IFT80 | | SRTD2 | 繊毛形成不全 | | 80) , *1 |
| IFT172 | | SRTD10 NPHP17 BBS20 | 繊毛形成不全 | | 81) , *1 |
| IFT-A複合体ペリフェラルサブ複合体 | IFT43 | | CED3 | 正常 | 逆行輸送の障害 | *1 |
| IFT121 | WDR35 | SRTD7 CED2 | 正常 | 逆行輸送の障害 | *1 |
| IFT139 | TTC21B | SRTD4 JBTS11 NPHP12 | 正常 | 逆行輸送の障害 | 21) |
| コアサブ複合体 | IFT122 | | CED1 | 繊毛の著しい短縮 | | 22) |
| IFT140 | | SRTD9 | | | |
| IFT144 | WDR19 | SRTD5 CED4 NPHP13 | 繊毛の短縮 | 繊毛内移行と逆行輸送の障害 | 21) |
| 膜結合タンパク質 | TULP3 | | | | | |
| BBSomeリンカーサブ複合体 | BBS4 | | BBS4 | 正常 | 逆行輸送および繊毛からの排出の障害 | 82) |
| BBS18 | BBIP10 | BBS18 | | | |
| BBS8 | TTC8 | BBS8 | | | |
| コアサブ複合体 | BBS2 | | BBS2 | 正常 | 逆行輸送および繊毛からの排出の障害 | 82) |
| BBS7 | | BBS7 | | | |
| BBS9 | | BBS9 | | | |
| BBS1 | | BBS1 | 正常 | 逆行輸送および繊毛からの排出の障害 | 25) |
| 膜結合タンパク質 | BBS5 | | BBS5 | | | |
| 低分子量GTPase | ARL6 | BBS3 | BBS3 | 正常 | 逆行輸送および繊毛からの排出の障害 | 53, 83) |
| キネシン2ヘテロ三量体 | KIF3A | | | 繊毛形成不全 | | 84) |
| KIF3B | | | 繊毛形成不全 | | 4, 26) |
| KIF3C | | | | | |
| KIFAP3 | KAP3 | | | | |
| ホモ二量体 | KIF17 | | | 正常 | 正常 | 55) |
| ダイニン2複合体H1サブ複合体 | DYNC2H1 | | SRTD3 | 繊毛の短縮 | 逆行輸送の障害 | 68) |
| DYNC2LI1 | | SRTD15 | 繊毛の著しい短縮 | | *1 |
| WDR34サブ複合体 | WDR34 | | SRTD11 | 繊毛の短縮 | 逆行輸送の障害 | 68) , *1 |
| DYNLL1 | | | | | |
| DYNLL2 | | | | | |
| DYNLRB1 | | | | | |
| DYNLRB2 | | | | | |
| WDR60サブ複合体 | WDR60 | | SRTD8 | 正常 | 逆行輸送の障害 | 27) |
| TCTEX1D2 | | SRTD17 | 正常 | 軽微な逆行輸送の障害 | 27) |
| DYNLT1 | | | | | |
| DYNLT3 | | | | | |
| KO:ノックアウト.*1筆者らの未発表データ. |
3. 観るだけでわかるタンパク質間相互作用解析法(VIPアッセイ)と改良型CRISPR-Cas9ゲノム編集法
1)VIPアッセイの開発
多数のサブユニットからなる巨大なIFT装置はどのようにして組み立てられるのだろうか? 筆者が繊毛の研究を始めた2012年ごろは,クラミドモナスのIFT装置に関する断片的な解析は行われていたが,その全体像は不明であった17, 18).一方,クラミドモナスのIFT遺伝子のヒトホモログは多数リストアップされていたが,それらの解析は進んでいなかった.ヒトのIFT装置を構成するサブユニットは,図2に示すように40種類以上にもなる.なかには,IFT172のように1000アミノ酸を超える大きなタンパク質も含まれる.このような大きなタンパク質を大腸菌や酵母などの微生物で発現させるのは困難な場合が多いので,酵母2ハイブリッド法やGSTプルダウン法などの既存の方法によるタンパク質間相互作用解析が進んでいなかったと推測される.実際に,筆者らは研究当初にこれらの方法を試したが,酵母や大腸菌でヒトのIFTタンパク質を可溶性で発現させることができず,相互作用解析を行うことができなかった.
次に筆者らは,微生物ではなくヒト胎児腎由来のHEK293T細胞を用いることにした.HEK293T細胞ならばヒト由来の大きなタンパク質でも発現させることができ,共免疫沈降法とウェスタンブロット法を組み合わせて用いて,タンパク質間相互作用を調べることが可能であった.しかし,IFT装置のサブユニットは数が多いので,この方法で網羅的な相互作用解析を行うのには手間も時間もかかりすぎるという問題があった.そのため,タンパク質間相互作用を簡便かつ迅速に解析する技術的なブレイクスルーが必要であった.
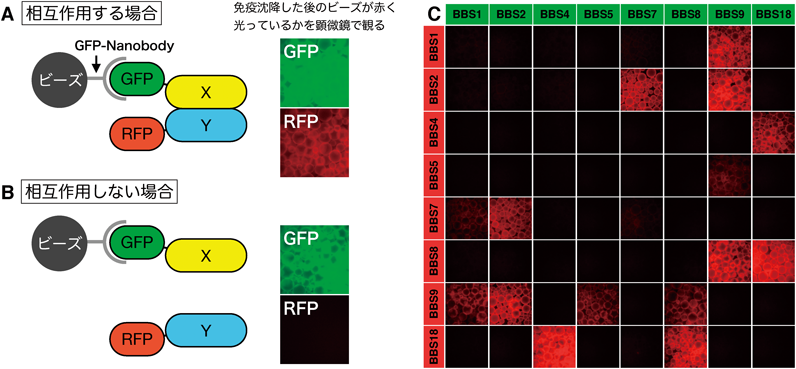
この問題を解決するために,筆者は「観るだけでわかるタンパク質間相互作用解析法:visible immunoprecipitation(VIP)アッセイ」という方法を開発した19, 20)(図3).VIPアッセイはGFP融合タンパク質とRFP融合タンパク質を用いた共免疫沈降法であり,基本的な原理は通常の共免疫沈降法と同じである.ただし,通常の共免疫沈降法との違いは,タンパク質間相互作用の検出にウェスタンブロット法を行うのではなく,蛍光顕微鏡を使う点にある.GFP融合タンパク質とRFP融合タンパク質が相互作用している場合,免疫沈降したビーズ上には両者が共存しているので,GFPとRFPの両方の蛍光が観察される.一方,両者が相互作用していない場合には,GFPの蛍光のみが観察される.つまり,「ビーズが赤く光っているかどうかを観るだけで,タンパク質間相互作用の有無がわかる」という単純な仕組みである.この方法ならば既存の方法よりも圧倒的に速く,相互作用の検出が可能である.
VIPアッセイのもう一つの工夫は,ラクダ科動物由来の単鎖抗体であるNanobodyを用いたことにある.筆者は,GFPと高親和性で結合する抗GFP-NanobodyにGSTタグを融合させたコンストラクトを作製し,それを大腸菌で発現させて精製した.VIPアッセイに適したよい抗体を好きなだけ作って免疫沈降実験に使うことができるようになった(免沈やり放題になった)ことで,IFT装置の網羅的解析の基盤が整った.筆者が作製したGFP-NanobodyのプラスミドはAddgeneから入手できるので,興味を持った方はぜひ試していただきたい.
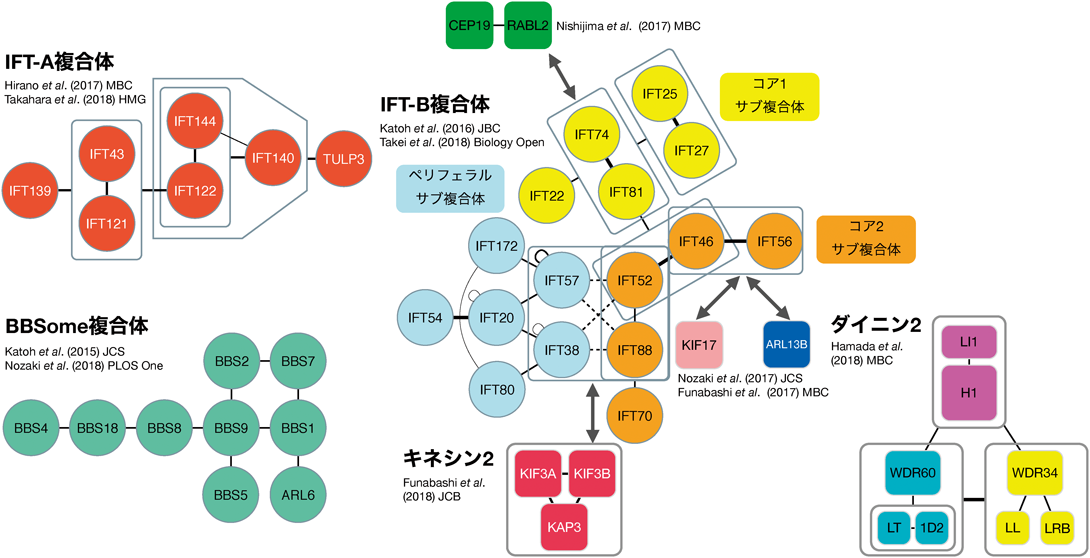
このような経緯で開発したVIPアッセイを駆使して,筆者らはこれまでにIFT-A複合体21, 22),IFT-B複合体23, 24),BBSome複合体19, 25),三量体キネシン226),ダイニン2複合体27)の構築様式を解明した(図4).VIPアッセイでは,単純な1対1のタンパク質間相互作用だけでなく,複数のタンパク質が関与する1対多や多対多の複雑な相互作用を調べることもできる.VIPアッセイのこのような利点を活かして,1対多や多対多の相互作用がカギになっている各複合体の構築様式だけでなく,IFT装置を構成する複合体間の相互作用様式も明らかにし,IFT装置の全体像を解き明かすことができた.
2)CRISPR-Cas9ゲノム編集法の改良
VIPアッセイによって明らかになったIFT装置の相互作用マップはどこまで正しいのだろうか? VIPアッセイでは,蛍光タンパク質という比較的大きなタグをつけているので,本来は起こらない相互作用が検出されたり,逆に相互作用が阻害されたりする偽陽性・偽陰性の恐れがある.VIPアッセイはあくまでもタンパク質の過剰発現による実験系なので,内在性のIFT装置が相互作用マップどおりに構築されているのかを別の角度から検証する必要があった.
筆者らが繊毛の研究を始めたのと時を同じくして,CRISPR-Cas9システムによる革新的なゲノム編集法が開発された28, 29).IFT装置による繊毛内タンパク質輸送機構を理解するためには,生化学的なアプローチだけでなく,遺伝学的なアプローチも必要と考えて,この技術を取り入れることにした.
ヒトの一次繊毛の研究には,不死化ヒト網膜色素上皮細胞(hTERT-RPE1,以下ではRPE1細胞と呼ぶ)がよく使われている.この細胞は血清飢餓によって細胞周期のG0期へと移行させて,一次繊毛の形成を誘導できることから,繊毛形成やIFT装置の研究には適している.また,この細胞株は,正常なヒト細胞をヒトテロメア逆転写酵素(human telomerase reverse transcriptase:hTERT)の過剰発現によって不死化したものなので,HeLaなどのがん細胞とは異なり,染色体が46本の正常な核型を有している30).標的となる遺伝子が2コピーであることは,遺伝子ノックアウト(KO)を行う上での利点である.その一方で,RPE1細胞は,がん由来の細胞株と比べて相同組換えの効率が悪いことや31),不死化の過程でピューロマイシンとハイグロマイシン耐性遺伝子が導入されているために,これらの抗生物質による選択ができないことなどの不利な点がある.
細胞内でゲノムDNAが切断されると,主として相同組換え,および非相同末端結合の二つの機構によって修復が起こる32, 33).前者は相同配列を鋳型にして修復するためにエラーは少ないが,細胞周期のS期後期からG2期にしか起こらないために効率は悪い.後者は鋳型を使わないのでエラーは多いが,細胞周期によらず起こるので効率はよい.実際に,非相同末端結合を利用して高効率のノックインが可能であることが,哺乳類細胞34–37)やゼブラフィッシュ38, 39)で報告されていた.
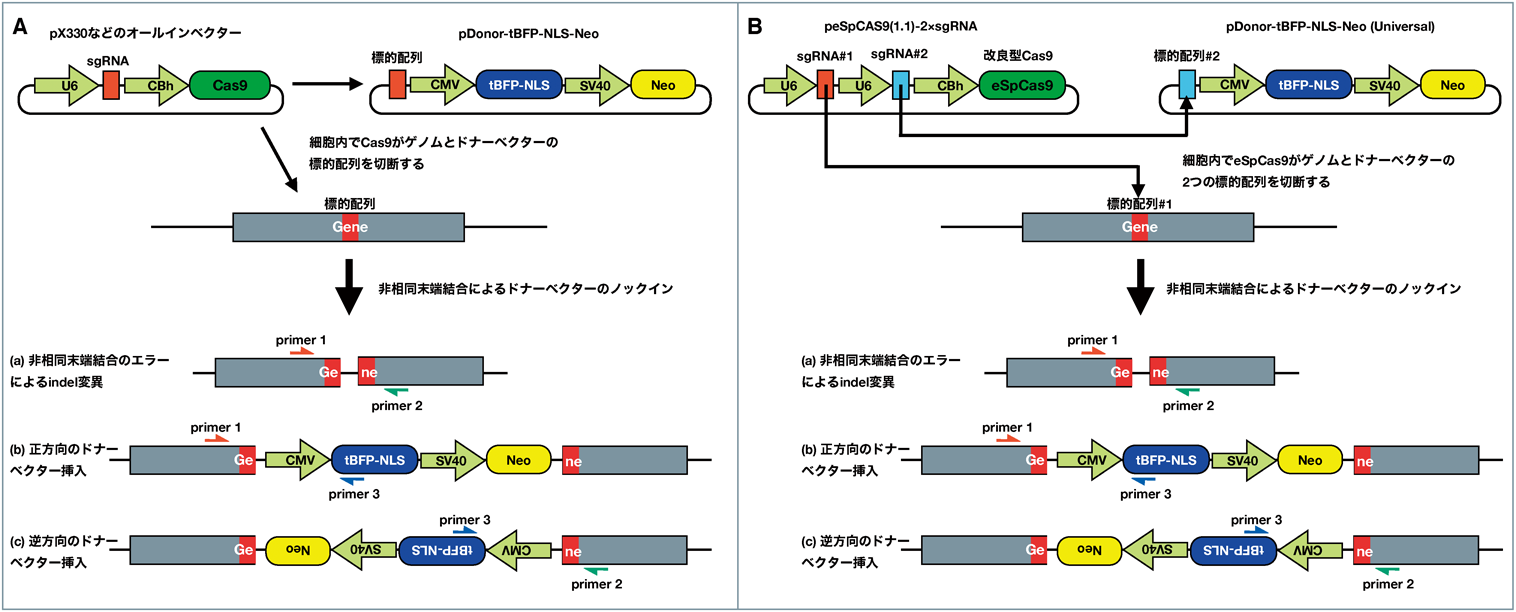
筆者は,RPE1細胞において効率的なKOを行うために,非相同末端結合によるゲノム編集に適したドナーベクターを構築した40)(図5A).このベクターはネオマシン耐性遺伝子と核局在化シグナル(NLS)を付加した青色蛍光タンパク質(tBFP)を持ち,さらにゲノム上の標的配列と同じ配列を組み込めるようになっている.ドナーベクターとオールインワンベクター(pX330など)をRPE1細胞にトランスフェクションすると,細胞内でCas9とsgRNA(single-guide RNA)が発現し,ゲノム上の標的配列とドナーベクターを切断する.切断されたゲノムを修復するために非相同末端結合による修復機構が働き,その際にドナーベクターが標的遺伝子部位に挿入される(ただし挿入の向きはランダムである).実際には,二つのアリルにドナーベクターが挿入されることはまれであり,一つのアリルにドナーベクターが挿入され,もう一方には修復時のエラーで生じたindel変異がみられる場合が多い(図5A, a~c).ドナーベクターがゲノムに組み込まれた細胞は,薬剤選択することができるだけでなく,核が青く光るので顕微鏡下で判別したり,セルソーターでクローニングしたりすることもできる.また,核の青色蛍光はその後の解析(免疫染色など)の邪魔になることが少ない.
さらにドナーベクターとオールインワンベクターに工夫を加えた改良版を開発した40)(図5B).ドナーベクターの標的配列としてヒトゲノム中にはない人工的な配列(PITCh-gRNA#3)41)を採用した.オールインワンベクターのCas9をオフターゲット切断の確率が低下した改良型のeSpCas9(1.1)に交換し42),ゲノム上の標的配列とドナーベクター上の標的配列に対する二つのsgRNA発現カセットを挿入した.これらの工夫により,ドナーベクターを毎回作る必要がなくなり,オフターゲット切断の可能性も低くなった.
以上に述べた方法を用いて,IFT装置のサブユニットを一つ一つKOし,これまでに30種類以上のKO細胞株を樹立している.KO細胞を樹立した後には,野生型の遺伝子を戻して表現型が回復することを必ず確認し,オフターゲット切断による影響ではないことを確かめている.さらに,IFT装置の構築に必要な相互作用ドメインを欠失させた変異体や繊毛病患者でみられる点変異体をKO細胞で発現させた際の表現型についても調べている.このような変異体を用いたレスキュー実験によって,IFT装置の各サブユニットの機能や繊毛病発症の分子基盤の解明が可能である.各サブユニットのKO細胞の表現型と繊毛病との関係について表1にまとめた.
以降では,VIPアッセイと改良型CRISPR-Cas9法を駆使した研究によって明らかになったIFT装置の各複合体の構築様式と各サブユニットの機能について解説する.
1)IFT-B複合体の構築様式
IFT-B複合体は,キネシン2によって推進される繊毛内の順行輸送に関与すると考えられる.16種類のサブユニットからなるIFT-B複合体は,コアとペリフェラルの二つのサブ複合体(B1, B2サブ複合体とも呼ばれる43))に分けられ,さらにコアサブ複合体はコア1とコア2のサブ複合体に分けることができる(図4).IFT-Bサブユニット間の相互作用解析の詳細については原著論文23)または生化学誌の「みにれびゅう」44)を参照いただきたい.
2)IFT-Bコア1サブ複合体
IFT-Bコア1(B1-1)サブ複合体は,IFT74–IFT81ヘテロ二量体に,IFT22とIFT25–IFT27ヘテロ二量体が結合した複合体である.
IFT74とIFT81は大部分がコイルドコイル(CC)領域からなり,この領域を介してヘテロ二量体を形成する.両者のN末端領域を介して,軸糸の構築材料となるチューブリン二量体と結合することから,IFT74–IFT81二量体は繊毛の形成と維持において必須のサブユニットである45, 46).
IFT22はRAB-Like 5(RABL5)の別名を持つ低分子量GTPaseの1種である47).細胞内小胞輸送の制御に関わるRABファミリーとは異なり,C末端での脂質修飾を受けないことから,RAB-Likeという別グループに分類されている.一般に,低分子量GTPaseはGTP結合型とGDP結合型の二つの状態をとり,GTP結合型(活性化型)のときにエフェクタータンパク質と相互作用することで分子スイッチとして働く.これまでにクラミドモナスや線虫のIFT22の機能解析は行われていたが,相反する結果であった48, 49).また,哺乳類細胞におけるIFT22の機能は調べられていなかった.そこで筆者らはIFT22のKO細胞を作製して,繊毛形成への影響とIFT装置や繊毛内に局在するGPCRなどの局在変化を調べた.しかし,IFT22-KO細胞には,調べた限りどこにも異常は認められなかった24).したがって,IFT22はIFT装置の基本的な機能には不要と考えられる.ただし,特定の組織や細胞においては何らかの働きをしている可能性があるので,今後はKOマウスなどの個体レベルでの解析が必要と思われる.
IFT25とIFT27は安定なヘテロ二量体を形成し,常に一体となって機能する50).IFT27は別名RAB-Like 4(RABL4)であり,IFT22(RABL5)と同じグループの低分子量GTPaseである.IFT25とIFT27のKO細胞ではともに繊毛が正常に形成されることから51–53),繊毛の形成においては必須サブユニットではない.しかし,これらのKO細胞ではBBSome複合体が繊毛内に蓄積し,GPCRが繊毛から排出されないという異常がみられることから52, 53),IFT25–IFT27二量体はIFT-B複合体とBBSome複合体の連結に関与する可能性がある.
3)IFT-Bコア2サブ複合体
IFT-Bコア2(B1-2)サブ複合体は,IFT46, IFT52, IFT56, IFT70A/B, IFT88の五つのサブユニットからなる.IFT46–IFT52ヘテロ二量体はIFT74–IFT81ヘテロ二量体と結合することによって,IFT-Bのコア1とコア2をつないでいる.IFT52にはIFT88が結合し,IFT52–IFT88ヘテロ二量体になるとIFT70が安定に結合できるようになる24).IFT56はIFT46と結合することで複合体に組み込まれる.
IFT46には既知のドメインやモチーフは見つかっていないが,C末端領域を介してIFT52と相互作用することがわかっている.クラミドモナスのIFT46のN末端領域が外腕ダイニンのODA16と相互作用することから54),哺乳類においても同様に積荷タンパク質と相互作用する可能性がある.
IFT52のN末端のGIFT(GldG intraflagellar transport)ドメインは,後述するIFT連結四量体の形成やヘテロ三量体キネシン2との相互作用に必要なドメインである26).IFT52のC末端領域は,IFT46, IFT70, IFT88の三つのサブユニットと相互作用する.IFT52はさまざまなサブユニットと相互作用することでIFT-B複合体の形成において中心的な役割を担っている.
IFT56はほぼ全体がTPR(tetratricopeptide repeat)ドメインからなるタンパク質であり,IFT46と結合する.IFT56のKO細胞では繊毛が正常に形成されることから,繊毛形成には必須のサブユニットではない55).しかし,IFT46–IFT56ヘテロ二量体にはホモ二量体キネシン2(KIF17)や低分子量GTPaseのARL13B[繊毛病のJoubert症候群(JBTS)の原因遺伝子JBTS8でもある]が結合することから,繊毛に局在する積荷タンパク質を認識するために必要なサブユニットと考えられる55, 56).
IFT70遺伝子はヒトではIFT70AとIFT70Bの二つが存在している.IFT70A/Bはほぼ全体がTPRドメインからなり,アミノ酸配列も95%が同一である.IFT70A/BのダブルKO細胞を作製したところ,繊毛はまったく形成されなかった24).IFT70A/BダブルKO細胞にIFT70AとIFT70Bのどちらかを発現させると繊毛形成が回復したので,IFT70AとIFT70Bの機能は重複していると考えられる.IFT70の繊毛形成における具体的な役割は今のところ不明である.IFT-B複合体の安定性を高めたり,他のタンパク質と相互作用したりすることによって,繊毛形成に必須の役割を果たしているのかもしれない.
IFT88もほぼ全体がTPRドメインからなるタンパク質である.IFT88はIFT52と結合するだけでなく,IFT-B連結四量体の形成にも必要であることから,IFT-B複合体形成の要になっていると考えられる.IFT88のKO細胞では繊毛がまったく形成されないことは,相互作用マップから考えて妥当な結果である40).
4)IFT-Bペリフェラルサブ複合体
IFT-Bペリフェラル(B2)サブ複合体はIFT20, IFT38, IFT54, IFT57, IFT80, IFT172の六つのサブユニットからなる.IFT20, IFT38, IFT54, IFT57はそれぞれのCC領域を介して相互作用する.IFT38とIFT80, IFT57とIFT172, IFT80とIFT172がそれぞれ相互作用する.これらのサブユニットのうちのどれをKOしても繊毛はまったく形成されないことから,どのサブユニットもIFT-B複合体において必須の役割を果たすと考えられる(表1).
IFT20はほぼ全体がCC領域からなるタンパク質で,IFTサブユニットのなかで最も小さい.しかし,このCC領域を介して,IFT38, IFT54, IFT57の三つのサブユニットと相互作用し,ペリフェラルサブ複合体内でハブ的な役割を果たす.IFT20は,繊毛だけでなくゴルジ体にも局在するという他のサブユニットにはない特徴を有する.IFT複合体のサブユニットとして働くだけでなく,ゴルジ体から繊毛への小胞輸送にも関与している可能性がある57).
IFT38はN末端にNN-CH(NDC80- NUF2 calponin homology)ドメイン,中央にCC領域を持つ.NN-CHドメインを介してIFT80のWD40ドメインと結合し,CC領域を介してIFT20と結合する.さらにIFT38はIFT-B連結四量体のサブユニットでもあることから,IFT-B複合体形成の中心となる重要なサブユニットであると考えられる.
IFT54はN末端にNN-CHドメイン,C末端にCC領域を持つ.NN-CHドメインを介してチューブリンと結合し43),CC領域を介してIFT20と結合する.IFT54-KO細胞にNN-CHドメイン欠失IFT54変異体を発現させると繊毛形成が回復したことから,IFT54とチューブリンの結合は繊毛形成に必須ではなく,IFT74–IFT81によるチューブリンの輸送が主要なものと考えられる(筆者らの未発表結果).
IFT57はN末端にNN-CHドメイン,C末端にCC領域を持つ.NN-CHドメインを介してIFT172のWD40ドメインと結合し,CC領域を介してIFT20と結合する.さらにIFT57はIFT-B連結四量体のサブユニットでもあることから,IFT38と同じくIFT-B複合体全体の構築において重要なサブユニットと考えられる.
IFT80はN末端側にWD40ドメインを持ちIFT38のNN-CHドメインと結合する.IFT172はIFTサブユニットのなかで最大のサブユニットであり,N末端側にWD40を持ち,それ以降はTPRドメインで構成されている.IFT172のWD40とIFT57のNN-CHドメインが結合し,IFT172のTPRはIFT80と結合する.IFT80とIFT172はともに短肋骨性胸郭異形成(SRTD)の原因遺伝子によってコードされる(表1).SRTDの原因遺伝子には,IFT-A複合体やダイニン2のサブユニットなど繊毛内の逆行輸送に関わるタンパク質をコードするものが多く含まれる.そのため,IFT80とIFT172が逆行輸送に関与している可能性がある.
5)IFT-B連結四量体
IFT-B複合体のコアサブ複合体とペリフェラルサブ複合体は,最終的に一つのIFT-B複合体を形成する.筆者らはサブトラクションVIPアッセイや多対多のVIPアッセイを用いた解析によって,IFT38, IFT52, IFT57, IFT88の四つがコアとペリフェラルサブ複合体の連結に必要であることを明らかにした44).筆者らはこれら四つのサブユニットからなる複合体をIFT-B連結四量体と呼んでいる.
IFT-B連結四量体はコアとペリフェラルサブ複合体の連結だけでなく,ヘテロ三量体キネシン2との結合部位でもある(後述)26).したがって,IFT-B連結四量体はIFT装置にとって心臓部ともいえる.
1)IFT-A複合体の構築様式
IFT-A複合体は,ダイニン2によって推進される繊毛内の逆行輸送に関与すると考えられる.IFT-A複合体は六つのサブユニットからなる.サブユニット数は少ないが,一つ一つのサイズが大きい(IFT43を除き,どれも120 kDa以上である)ために,最近まで解析があまり進んでいなかった.これまでに,哺乳類細胞では,IFT122, IFT140, IFT144がIFT-Aコアサブ複合体を形成することや,IFT-Aコアサブ複合体にはTULP3[PtdIns(4,5)P2と結合するTubbyドメインを持つ]が結合することなどがわかっていた58).また,TULP3はGPCRにも結合することから,IFT複合体とGPCRなどの積荷タンパク質を連結するアダプタータンパク質として機能していると考えられる59).
筆者らはVIPアッセイを用いた相互作用解析によって,IFT122, IFT140, IFT144によるIFT-Aコアサブ複合体と,IFT43–IFT121ヘテロ二量体とIFT139によるIFT-Aペリフェラルサブ複合体が形成されることを見いだし,二つのサブ複合体は,IFT122とIFT43–IFT121ヘテロ二量体によって連結されることを明らかにした21).
2)IFT-Aコアサブ複合体
IFT-A複合体の相互作用マップから,IFT122はコアサブ複合体とペリフェラルサブ複合体をつなぐ重要なサブユニットと予想された.また,IFT122の変異は,繊毛病の一種である頭蓋外胚葉異形成(cranioectodermal dysplasia:CED)を引き起こすことが知られている.そこで筆者らは,IFT122の機能とCEDの発症メカニズムを解明するために,IFT122のKO細胞を樹立した.IFT122-KO細胞では繊毛の著しい短縮が認められたので,IFT122は繊毛内逆行輸送だけでなく,繊毛形成においても重要な役割を果たす可能性が示唆された.次に,CEDの原因となる点変異を導入したIFT122に関して相互作用解析を行ったところ,CED型IFT122変異体は完全なIFT-A複合体を構築できないことがわかった.また,CED型IFT122をIFT122-KO細胞で発現させると,繊毛の形成は回復するが,繊毛に局在するGPCRの逆行輸送が障害されていることが判明した.このような逆行輸送の異常がCEDの発症につながると考えられる22).
IFT144は,相互作用マップから考えて,IFT-Aコアサブ複合体形成にとって重要であると予想される.IFT144-KO細胞を樹立したところ,繊毛の短縮がみられた.IFT144-KO細胞の繊毛内にはIFT-A複合体がまったく存在しなかったことから,IFT144がなければIFT-A複合体の構築自体ができないと考えられる.一方,IFT144-KO細胞において,IFT-B複合体は繊毛の先端に蓄積していた.このことは,IFT-B複合体の構築と繊毛内順行輸送はIFT-A非依存的に進行することを示唆する.さらに,IFT144-KO細胞では,繊毛に本来局在するはずのGPCR(GPR161, SSTR3, MCHR1など)が局在できなくなっていた21).これまでは,IFT-A複合体は繊毛内の逆行輸送を担うと考えられていたが,それに加えて,IFT-A複合体はTULP3を介してGPCRを積荷として認識し,繊毛内へと運び込む働きも担っていると考えられる21, 59).
3)IFT-Aペリフェラルサブ複合体
IFT-A複合体の相互作用マップの端に位置するIFT139をKOした細胞では,繊毛形成は正常であったが,IFT-AとIFT-B複合体ともに繊毛の先端に蓄積していた.IFT139がないことによって,IFT装置が繊毛先端で方向転換できない,あるいは逆行輸送が障害されていると考えられる.
繊毛に局在するGPCRのGPR161とSmoothened(SMO)は,ヘッジホッグ(Hh)シグナルの活性化によって局在を変化させることがわかっている.すなわち,Hhシグナルがオフのときに,GPR161は繊毛内に局在するがSMOは局在しないのに対して,HhシグナルがオンのときはGPR161が繊毛外へ排出されるとともに,SMOが繊毛内へと移行する.IFT139-KO細胞において,これらのGPCRの挙動を調べると,HhシグナルがオンになってもGPR161が繊毛外へ排出されないこと,およびHhシグナルがオフのときでもSMOが繊毛内に局在していることが明らかになった.これらの観察結果は,IFT139がGPCRの繊毛内逆行輸送において重要な働きを担っていることを示唆する21).
IFT43とIFT121のKO細胞では,どちらも繊毛の形成は正常だが,逆行輸送が障害されるというIFT139-KO細胞とよく似た表現型がみられる22)(表1).
BBSome複合体はBardet-Biedl症候群(BBS)の原因遺伝子によってコードされる八つのサブユニット(BBS1, BBS2, BBS4, BBS5, BBS7, BBS8, BBS9, BBS18)からなる19, 25).BBS1, BBS2, BBS7, BBS9は四者でBBSomeのコアサブ複合体を形成する.BBS4とBBS8はBBS18を介してリンカーサブ複合体を形成する.膜結合ドメインであるPHドメインを持つBBS5は,BBS9を介してコアサブ複合体と結合する.低分子量GTPaseの一種で,BBSの原因遺伝子によってコードされるARL6(BBS3)は,GTP結合型(活性化型)になるとBBS1に結合し,BBSome複合体を膜へリクルートする働きがある.
BBSome複合体の機能を詳しく調べるために,筆者らはBBS1のKO細胞を樹立して表現型解析を行った.BBS1-KO細胞では,繊毛は正常に形成され,IFT-A複合体やIFT-B複合体の局在にも異常はみられなかった.しかし,BBS9などBBSomeのサブユニットは繊毛内に観察されなくなった.この結果は,BBSome複合体が構築されていないか,繊毛内への移行が障害されているためと考えられる.さらにBBS1-KO細胞では,GPR161などのGPCRが繊毛外へ排出されず,繊毛内に蓄積するようすが観察された.BBSome複合体が発見された当初は,GPCRの繊毛内への移行に関与するアダプタータンパク質ではないかと考えられていたが,筆者たちや他のグループの研究から,BBSome複合体はGPCRの繊毛外への排出の際に必要なアダプタータンパク質であると現在では考えられている25, 60).
BBSome複合体とIFT-A/B複合体は一体となって機能するが,常に結合しているわけではないと考えられる.その理由として,IFTサブユニットとBBSomeサブユニットの抗体を用いてRPE1細胞の免疫染色を行うと,IFT複合体は繊毛に必ず局在しているのに対して,BBSome複合体は10~30%の繊毛にしか局在していないことがある.BBSome複合体が局在している繊毛としていない繊毛が混在している理由はわかっていないが,BBSome複合体が繊毛内に移行するときやGPCRを繊毛外へ排出するときにだけIFT複合体と一過的に相互作用するのかもしれない.
繊毛の軸糸微小管は,基部がマイナス端で先端がプラス端である.IFT装置の順行輸送には,プラス端方向へ動くキネシンスーパーファミリーのうちのキネシン2がモータータンパク質として働いている.キネシン2にはヘテロ三量体キネシン2(KIF3A/KIF3B/KAP3からなる)とホモ二量体キネシン2(KIF17)がある61).線虫の繊毛では,これら2種類のキネシンが使い分けられており,繊毛基部から中間部まではヘテロ三量体キネシン2が,中間部から先端まではホモ二量体キネシン2がモーターとして働く62).しかし脊椎動物においては,ヘテロ三量体キネシン2とホモ二量体キネシン2が両方ともIFT装置のモーターとして働いているのか,またどのように使い分けられているのかについてはよくわかっていなかった.
1)ホモ二量体キネシン2(KIF17)
まず筆者らは,KIF17がIFT複合体に結合するのかどうかについてVIPアッセイを用いて調べた.その結果,KIF17がIFT-B複合体のIFT46–IFT56ヘテロ二量体と結合することがわかった.次に,KIF17-KO細胞を樹立して調べたところ,繊毛は正常に形成されたことから,KIF17は繊毛形成にとって必須ではないことがわかった.そこで,KIF17が自身のモーター活性によって繊毛内を動いているのか,それともIFT装置の積荷として運ばれているのかを調べた.KIF17のモータードメインを欠失させた変異体が繊毛の先端に局在したことから,KIF17はIFT装置の積荷タンパク質として先端まで運ばれていると考えられる.また,IFT56-KO細胞ではKIF17が繊毛先端に局在しなくなることから,KIF17はIFT46–IFT56二量体を介してIFT装置に積み込まれることが裏づけられた.さらに,KIF17のC末端にある核局在化シグナル様のモチーフとImportinとの相互作用が繊毛ゲートを通過する際に必要であることも明らかになった.この結果は,繊毛ゲートには核膜孔に似た構造があるという仮説と矛盾しない63).以上の結果から,KIF17はIFT装置のモータータンパク質として働くのではなく,IFT装置の積荷として繊毛先端にまで運ばれていると結論づけた55).
KIF17のKOマウスやKOゼブラフィッシュで発生段階において大きな異常が認められないことから,脊椎動物におけるKIF17の機能は不明である64, 65).
2)ヘテロ三量体キネシン2(KIF3A/KIF3B/KAP3)
ヘテロ三量体キネシン2はモータードメインを持つKIF3AとKIF3B, Armadilloリピートを持つKAP3によって構成される.KIF3AとKIF3BはC末端側のCC領域を介してヘテロ二量体を形成し,両者はそれぞれKAP3とも結合する.
ヘテロ三量体キネシン2がIFT装置のモータータンパク質として働いていることは,クラミドモナスやマウスなどの遺伝学的な解析からすでにわかっていた4, 9).しかし,ヘテロ三量体キネシン2がIFT複合体とどのように相互作用しているのかについては,いくつかの報告がなされていたが結論が得られない状況が長く続いていた.筆者らは,IFT複合体のサブトラクションVIPアッセイなどを行うことによって,IFT-B連結四量体(IFT38, IFT52, IFT57, IFT88)がヘテロ三量体キネシン2との結合部位であることを突き止めた26).結合部位が生化学的にこれまで同定できていなかったのは,3対4の複数サブユニットが関与する複雑な相互作用だったためと考えられる.
次にKIF3BのKO細胞を作製したところ,KOマウスに関する先行研究から予想されたとおり,繊毛はまったく形成されなかった.KIF3B-KO細胞に野生型のKIF3Bを発現させると繊毛形成が回復したのに対して,KIF3AおよびKAP3とは結合するがIFT-B複合体とは相互作用しないか,相互作用が減弱する変異型KIF3Bを発現させても繊毛形成はまったく回復しなかった.これらの結果から,ヘテロ三量体キネシン2はIFT-B連結四量体を介してIFT-B複合体と相互作用することでモーターとして機能できるようになり,繊毛形成に必須のチューブリンなどの積荷タンパク質の繊毛基部から先端への順行輸送を媒介すると考えられる.
ダイニンは微小管のマイナス方向に運動するモータータンパク質である.ダイニンは,運動性繊毛の運動性を持たらす軸糸ダイニンと,細胞質で働く細胞質ダイニンの2種類に大別できる.さらに細胞質ダイニンにはダイニン1とダイニン2の2種類がある.細胞質ダイニン1は細胞質での輸送小胞やさまざまなオルガネラの輸送,細胞分裂時の染色体の分離過程などで働く.ダイニン2は繊毛内での逆行輸送専用のモータータンパク質である66).ダイニン2は細胞質ダイニンに分類されるが,繊毛内で機能することに注意が必要である.
ダイニン2は,重鎖(DYNC2H1),二つの中間鎖(WDR34とWDR60),中間軽鎖(DYNC2LI1),複数の軽鎖(DYNLL1/DYNLL2, DYNLT1/DYNLT3/TCTEX1D2, DYNLRB1/DYNLRB2)からなる67).重鎖は4000アミノ酸を超える巨大タンパク質であり,C末端側のAAA(ATPase associated with diverse cellular activities)ドメインやストーク領域がモーターとして働く.重鎖,中間鎖,中間軽鎖および軽鎖のTCTEX1D2はダイニン2特異的なサブユニットである.一方,TCTEX1D2以外の軽鎖はダイニン1と共用である.ダイニン2特異的なサブユニットの変異は繊毛病の短肋骨性胸郭異形成(SRTD)の原因となる68).100アミノ酸程度の小さなタンパク質である軽鎖は,相同性から三つのグループ(DYNLL1/DYNLL2, DYNLT1/DYNLT3, DYNLRB1/DYNLRB2)に分けることができ,各グループの軽鎖の機能は重複していると予想される.重鎖のN末端領域には中間鎖,中間軽鎖,軽鎖が結合することが予想されていたが,詳しい構築様式はわかっていなかった.
ダイニン2複合体の構築様式を明らかにするために,筆者らは11種類のサブユニットに関してさまざまなVIPアッセイを行った.まず,DYNLL1/DYNLL2とDYNLRB1/DYNLRB2がWDR34のN末端側のそれぞれ別の領域に結合してサブ複合体を形成すること,およびTCTEX1D2とDYNLT1/DYNLT3がヘテロ二量体を形成し,WDR60のN末端側領域に結合してサブ複合体を形成することがわかった.さらに,軽鎖が結合したWDR34サブ複合体とWDR60サブ複合体は,DYNC2H1–DYNC2LI1サブ複合体と安定な複合体を形成できることを初めて明らかにした27).
ダイニン2の各サブユニットの機能を解明するために,まずはWDR60とTCTEX1D2のKO細胞を樹立した.WDR60-KO細胞とTCTEX1D2-KO細胞では,繊毛は形成されるが,順行輸送に関与するIFT-B複合体や,Hhシグナルに応答して繊毛から排出されるはずのGPR161が繊毛内に蓄積していた.このような表現型は,WDR60-KO細胞の方がTCTEX1D2-KO細胞よりも顕著であった.WDR60-KO細胞に野生型WDR60を発現させると,繊毛タンパク質の異常な蓄積は解消された.一方,DYNLT1–TCTEX1D2ヘテロ二量体に結合できないWDR60変異体を発現させると,IFT-B複合体やGPR161の繊毛内への異常な蓄積は完全には解消されず,TCTEX1D2-KO細胞と同程度にまでなった.これらの結果から,WDR60とTCTEX1D2の相互作用がダイニン2による繊毛内の逆行輸送にとって必要であることが実証された27).筆者らは現在,WDR34やDYNC2LI1などの他のサブユニットに関する研究も進めている.
9. IFT複合体と相互作用するその他のタンパク質
1)RABL2
IFT22(RABL5)とIFT27(RABL4)がRAB-Likeグループに属することから,RABL2も繊毛に関与する低分子量GTPaseではないかと筆者らは予想した.VIPアッセイによる相互作用解析を行うことによって,RABL2は活性型のときにIFT74–IFT81ヘテロ二量体と相互作用することを発見した69).RABL2はCEP19という中心体局在タンパク質と結合することで基底小体に局在していることから,RABL2はIFT装置と基底小体近傍で一過的に相互作用することによって,IFT装置の形成,またはIFT装置の繊毛内への進入を調節している可能性が考えられる70).
2)ARL13B
ARL13BはARF/ARLファミリーに属する低分子量GTPaseであり,その変異はJoubert症候群を引き起こす(JBTS8).ARL13Bはホスホイノシチド-5-ホスファターゼであるINPP5E(その変異もJoubert症候群の原因,JBTS1)と結合することによって繊毛内へ運ぶ働きがある.VIPアッセイによって,筆者らはARL13BがIFT46–IFT56二量体と相互作用することを見いだした56).しかし,IFT複合体と相互作用できないARL13B変異体が繊毛に局在したことから,ARL13BはIFT複合体の積荷として運ばれているのではないと考えられる.したがって,この相互作用の生理的意義は今のところ不明である.
これまでの研究によって,IFT-A, IFT-B, BBSome,キネシン2,ダイニン2の各複合体の構築様式はほぼ明らかになった(図4).これらの複合体どうしがさらに相互作用することによってIFT装置全体が形成するはずであるが,その詳細はわかっていない.IFT-B連結四量体と三量体キネシン2の例のように,単純な1対1の相互作用ではなく,複数のサブユニットが関与する複雑な相互作用によってIFT装置全体が構築されるのかもしれない.
IFT装置が繊毛の先端まで到達すると,キネシン2のモーター活性がオフになり,ダイニン2の活性はオンになると考えられる.しかし,二つのモータータンパク質がどのようにして切り替わるのかはよくわかっていない.これまでに,繊毛先端に局在するキナーゼであるICKによるKIF3Aのリン酸化がIFT装置の方向転換に関与しているという報告があるが71),IFT複合体やダイニン2がリン酸化を受ける可能性も考えられる.IFT装置が方向転換をする繊毛の先端で何が起きているか解明することは今後の重要な課題である.
繊毛内と細胞質は繊毛ゲートによって隔離されており,およそ40 kDa以上のタンパク質は単純な拡散によって繊毛内に入ることはできない72, 73).しかし,IFT172の一つだけでも約200 kDaもあるIFT装置や,4000アミノ酸を超える重鎖を含むダイニン2複合体や軸糸ダイニン複合体がどのようにして繊毛内に運び込まれるのかは不明である.このような繊毛内外への移行が繊毛ゲートによってどのように制御されているのかも,今後の解決すべき課題である.
繊毛の構造は光学顕微鏡の分解能以下であることから,超解像顕微鏡を用いた微細構造の解析が進んでいる74, 75).このような高度な顕微鏡法を用いた観察がますます必要とされるだろう.また,膨張顕微鏡法76, 77)という新しい超解像顕微鏡法もこれからの繊毛研究に応用できると考えられることから,筆者らはこの方法の改良に取り組んでいる.今後,さまざまな超解像顕微鏡法を用いた観察によって,繊毛の微細構造とIFT装置の機能との関連が明らかになると思われる.
IFT装置の異常は,繊毛形成や繊毛を介するシグナル伝達の異常を生じさせ,ひいてはさまざまな繊毛病を引き起こす.近年の次世代シーケンサーの普及に伴って,繊毛病の原因となる遺伝子変異の発見が加速しているが,その変異によって何が異常になり,なぜ病気になるのかはわからないのが現状である.今後の研究によって繊毛病発症の分子基盤が解明され,繊毛病を標的とする創薬や,将来的にはゲノム編集を利用した遺伝子治療へと発展していくことが期待される.
謝辞Acknowledgments
本研究は京都大学大学院,薬学研究科,生体情報制御学分野で行われた.中山和久教授ならびにこれまで一緒に研究を行ってくれた大学院生たちに感謝の意を表する.
引用文献References
1) Garcia-Gonzalo, F.R. & Reiter, J.F. (2017) Open Sesame:How Transition Fibers and the Transition Zone Control Ciliary Composition. Cold Spring Harb. Perspect. Biol., 9, a028134–a21.
2) Garcia-Gonzalo, F.R., Phua, S.C., Roberson, E.C., Garcia, G. 3rd, Abedin, M., Schurmans, S., Inoue, T., & Reiter, J.F. (2015) Phosphoinositides Regulate Ciliary Protein Trafficking to Modulate Hedgehog Signaling. Dev. Cell, 34, 400–409.
3) Chávez, M., Ena, S., Van Sande, J., de Kerchove d’Exaerde, A., Schurmans, S., & Schiffmann, S.N. (2015) Modulation of Ciliary Phosphoinositide Content Regulates Trafficking and Sonic Hedgehog Signaling Output. Dev. Cell, 34, 338–350.
4) Nonaka, S., Tanaka, Y., Okada, Y., Takeda, S., Harada, A., Kanai, Y., Kido, M., & Hirokawa, N. (1998) Randomization of Left-Right Asymmetry due to Loss of Nodal Cilia Generating Leftward Flow of Extraembryonic Fluid in Mice Lacking KIF3B Motor Protein. Cell, 95, 829–837.
5) Bloodgood, R.A. (2009) From Central to Rudimentary to Primary: The History of an Underappreciated Organelle Whose Time Has Come. The Primary Cilium. Methods Cell Biol., 94, 3–52.
6) Pazour, G.J., Dickert, B.L., Vucica, Y., Seeley, E.S., Rosenbaum, J.L., Witman, G.B., & Cole, D.G. (2000) Chlamydomonas IFT88 and Its Mouse Homologue, Polycystic Kidney Disease Gene Tg737, Are Required for Assembly of Cilia and Flagella. J. Cell Biol., 151, 709–718.
7) Reiter, J.F. & Leroux, M.R. (2017) Genes and Molecular Pathways Underpinning Ciliopathies. Nat. Rev. Mol. Cell Biol., 18, 533–547.
8) Kozminski, K.G., Johnson, K.A., Forscher, P., & Rosenbaum, J.L. (1993) A Motility in the Eukaryotic Flagellum Unrelated to Flagellar Beating. Proc. Natl. Acad. Sci. USA, 90, 5519–5523.
9) Kozminski, K.G., Beech, P.L., & Rosenbaum, J.L. (1995) The Chlamydomonas Kinesin-like Protein FLA10 Is Involved in Motility Associated with the Flagellar Membrane. J. Cell Biol., 131, 1517–1527.
10) Pazour, G.J., Wilkerson, C.G., & Witman, G.B. (1998) A Dynein Light Chain Is Essential for the Retrograde Particle Movement of Intraflagellar Transport (IFT). J. Cell Biol., 141, 979–992.
11) Rosenbaum, J.L. & Witman, G.B. (2002) Intraflagellar Transport. Nat. Rev. Mol. Cell Biol., 3, 813–825.
12) Cole, D.G., Diener, D.R., Himelblau, A.L., Beech, P.L., Fuster, J.C., & Rosenbaum, J.L. (1998) Chlamydomonas Kinesin-II-dependent Intraflagellar Transport (IFT):IFT Particles Contain Proteins Required for Ciliary Assembly in Caenorhabditis elegans Sensory Neurons. J. Cell Biol., 141, 993–1008.
13) Stepanek, L. & Pigino, G. (2016) Microtubule Doublets are Double-track Railways for Intraflagellar Transport Trains. Science, 352, 721–724.
14) Nachury, M.V., Loktev, A.V., Zhang, Q., Westlake, C.J., Peränen, J., Merdes, A., Slusarski, D.C., Scheller, R.H., Bazan, J.F., Sheffield, V.C., et al. (2007) A Core Complex of BBS Proteins Cooperates with the GTPase Rab8 to Promote Ciliary Membrane Biogenesis. Cell, 129, 1201–1213.
15) Jin, H., White, S.R., Shida, T., Schulz, S., Aguiar, M., Gygi, S.P., Bazan, J.F., & Nachury, M.V. (2010) The Conserved Bardet-Biedl Syndrome Proteins Assemble a Coat that Traffics Membrane Proteins to Cilia. Cell, 141, 1208–1219.
16) Nakayama, K. & Katoh, Y. (2018) Ciliary Protein Trafficking Mediated by IFT and BBSome Complexes with the Aid of Kinesin-2 and Dynein-2 Motors. J. Biochem., 163, 155–164.
17) Lucker, B.F., Behal, R.H., Qin, H., Siron, L.C., Taggart, W.D., Rosenbaum, J.L., & Cole, D.G. (2005) Characterization of the Intraflagellar Transport Complex B Core:Direct Interaction of the IFT81 and IFT74/72 Subunits. J. Biol. Chem., 280, 27688–27696.
18) Lucker, B.F., Miller, M.S., Dziedzic, S.A., Blackmarr, P.T., & Cole, D.G. (2010) Direct Interactions of Intraflagellar Transport Complex B Proteins IFT88, IFT52, and IFT46. J. Biol. Chem., 285, 21508–21518.
19) Katoh, Y., Nozaki, S., Hartanto, D., Miyano, R., & Nakayama, K. (2015) Architectures of Multisubunit Complexes Revealed by a Visible Immunoprecipitation Assay Using Fluorescent Fusion Proteins. J. Cell Sci., 128, 2351–2362.
20) Katoh, Y., Nakamura, K., & Nakayama, K. (2018) Visible Immunoprecipitation (VIP) Assay:a Simple and Versatile Method for Visual Detection of Protein-protein Interactions. Bio Protoc., 7, e2687.
21) Hirano, T., Katoh, Y., & Nakayama, K. (2017) Intraflagellar Transport-A Complex Mediates Ciliary Entry and Retrograde Trafficking of Ciliary G Protein-coupled Receptors. Mol. Biol. Cell, 28, 429–439.
22) Takahara, M., Katoh, Y., Nakamura, K., Hirano, T., Sugawa, M., Tsurumi, Y., & Nakayama, K. (2018) Ciliopathy-associated Mutations of IFT122 Impair Ciliary Protein Trafficking but not Ciliogenesis. Hum. Mol. Genet., 27, 516–528.
23) Katoh, Y., Terada, M., Nishijima, Y., Takei, R., Nozaki, S., Hamada, H., & Nakayama, K. (2016) Overall Architecture of the Intraflagellar Transport (IFT)-B Complex Containing Cluap1/IFT38 as an Essential Component of the IFT-B Peripheral Subcomplex. J. Biol. Chem., 291, 10962–10975.
24) Takei, R., Katoh, Y., & Nakayama, K. (2018) Robust Interaction of IFT70 with IFT52-IFT88 in the IFT-B Complex Is Required for Ciliogenesis. Biol. Open, 7, bio033241.
25) Nozaki, S., Katoh, Y., Kobayashi, T., & Nakayama, K. (2018) BBS1 is Involved in Retrograde Trafficking of Ciliary GPCRs in the Context of the BBSome Complex. PLoS One, 13, e0195005.
26) Funabashi, T., Katoh, Y., Okazaki, M., Sugawa, M., & Nakayama, K. (2018) Interaction of Heterotrimeric Kinesin-II with IFT-B-connecting Tetramer Is Crucial for Ciliogenesis. J. Cell Biol., 217, 2867–2876.
27) Hamada, Y., Tsurumi, Y., Nozaki, S., Katoh, Y., & Nakayama, K. (2018) Interaction of WDR60 Intermediate Chain with TCTEX1D2 Light Chain of the Dynein-2 Complex Is Crucial for Ciliary Protein Trafficking. Mol. Biol. Cell, 29, 1628–1639.
28) Doudna, J.A. & Charpentier, E. (2014) The New Frontier of Genome Engineering with CRISPR-Cas9. Science, 346, 1258096–1258096.
29) Hsu, P.D., Lander, E.S., & Zhang, F. (2014) Development and Applications of CRISPR-Cas9 for Genome Engineering. Cell, 157, 1262–1278.
30) Bodnar, A.G., Ouellette, M., Frolkis, M., Holt, S.E., Chiu, C.P., Morin, G.B., Harley, C.B., Shay, J.W., Lichtsteiner, S., & Wright, W.E. (1998) Extension of Life-span by Introduction of Telomerase into Normal Human Cells. Science, 279, 349–352.
31) Miyamoto, T., Hosoba, K., Ochiai, H., Royba, E., Izumi, H., Sakuma, T., Yamamoto, T., Dynlacht, B.D., & Matsuura, S. (2015) The Microtubule-Depolymerizing Activity of a Mitotic Kinesin Protein KIF2A Drives Primary Cilia Disassembly Coupled with Cell Proliferation. Cell Reports, 10, 664–673.
32) Jasin, M. & Haber, J.E. (2016) The Democratization of Gene Editing:Insights from Site-specific Cleavage and Double-strand Break Repair. DNA Repair (Amst.), 44, 6–16.
33) Mladenov, E., Magin, S., Soni, A., & Iliakis, G. (2016) DNA Double-strand-break Repair in Higher Eukaryotes and Its Role in Genomic Instability and Cancer: Cell Cycle and Proliferation-dependent Regulation. Semin. Cancer Biol., 37-38, 51–64.
34) Cristea, S., Freyvert, Y., Santiago, Y., Holmes, M.C., Urnov, F.D., Gregory, P.D., & Cost, G.J. (2013) In vivo Cleavage of Transgene Donors Promotes Nuclease-mediated Targeted Integration. Biotechnol. Bioeng., 110, 871–880.
35) Maresca, M., Lin, V.G., Guo, N., & Yang, Y. (2013) Obligate Ligation-Gated Recombination (ObLiGaRe): Custom-designed Nuclease-mediated Targeted Integration through Nonhomologous End Joining. Genome Res., 23, 539–546.
36) Lackner, D.H., Carré, A., Guzzardo, P.M., Banning, C., Mangena, R., Henley, T., Oberndorfer, S., Gapp, B.V., Nijman, S.M.B., Brummelkamp, T.R., et al. (2015) A Generic Strategy for CRISPR-Cas9-mediated Gene Tagging. Nat. Commun., 6, 10237.
37) Geisinger, J.M., Turan, S., Hernandez, S., Spector, L.P., & Calos, M.P. (2016) In vivo Blunt-end Cloning through CRISPR/Cas9-facilitated Non-homologous End-joining. Nucleic Acids Res., 44, e76.
38) Auer, T.O., Duroure, K., De Cian, A., Concordet, J.P., & Del Bene, F. (2014) Highly Efficient CRISPR/Cas9-mediated Knock-in in Zebrafish by Homology-independent DNA Repair. Genome Res., 24, 142–153.
39) Kimura, Y., Hisano, Y., Kawahara, A., & Higashijima, S. (2014) Efficient Generation of Knock-in Transgenic Zebrafish Carrying Reporter/Driver Genes by CRISPR/Cas9-mediated Genome Engineering. Sci. Rep., 4, 6545.
40) Katoh, Y., Michisaka, S., Nozaki, S., Funabashi, T., Hirano, T., Takei, R., & Nakayama, K. (2017) Practical Method for Targeted Disruption of Cilia-related Genes by Using CRISPR/Cas9-mediated Homology-independent Knock-in System. Mol. Biol. Cell, 28, 898–906.
41) Sakuma, T., Nakade, S., Sakane, Y., Suzuki, K.T., & Yamamoto, T. (2015) MMEJ-assisted Gene Knock-in Using TALENs and CRISPR-Cas9 with the PITCh Systems. Nat. Protoc., 11, 118–133.
42) Slaymaker, I.M., Gao, L., Zetsche, B., Scott, D.A., Yan, W.X., & Zhang, F. (2016) Rationally Engineered Cas9 Nucleases with Improved Specificity. Science, 351, 84–88.
43) Taschner, M., Weber, K., Mourão, A., Vetter, M., Awasthi, M., Stiegler, M., Bhogaraju, S., & Lorentzen, E. (2016) Intraflagellar Transport Proteins 172, 80, 57, 54, 38, and 20 Form a Stable Tubulin-binding IFT-B2 Complex. EMBO J., 35, 773–790.
44) 加藤洋平,中山和久(2017)“観るだけでわかるタンパク質間相互作用解析法(VIPアッセイ)”を活用した繊毛内タンパク質輸送複合体IFT-Bの構築様式の解明,生化学,89, 273–277.
45) Bhogaraju, S., Cajanek, L., Fort, C., Blisnick, T., Weber, K., Taschner, M., Mizuno, N., Lamla, S., Bastin, P., Nigg, E.A., et al. (2013) Molecular Basis of Tubulin Transport within the Cilium by IFT74 and IFT81. Science, 341, 1009–1012.
46) Kubo, T., Brown, J.M., Bellve, K., Craige, B., Craft, J.M., Fogarty, K., Lechtreck, K.F., & Witman, G.B. (2016) Together, the IFT81 and IFT74 N-termini Form the Major Module for Intraflagellar Transport of Tubulin. J. Cell Sci., 129, 2106–2119.
47) Li, Y. & Hu, J. (2011) Small GTPases and Cilia. Protein Cell, 2, 13–25.
48) Schafer, J.C., Winkelbauer, M.E., Williams, C.L., Haycraft, C.J., Desmond, R.A., & Yoder, B.K. (2006) IFTA-2 Is a Conserved Cilia Protein Involved in Pathways Regulating Longevity and Dauer Formation in Caenorhabditis elegans. J. Cell Sci., 119, 4088–4100.
49) Silva, D.A., Huang, X., Behal, R.H., Cole, D.G., & Qin, H. (2012) The RABL5 Homolog IFT22 Regulates the Cellular Pool Size and the Amount of IFT Particles Partitioned to the Flagellar Compartment in Chlamydomonas reinhardtii. Cytoskeleton (Hoboken), 69, 33–48.
50) Bhogaraju, S., Taschner, M., Morawetz, M., Basquin, C., & Lorentzen, E. (2011) Crystal Structure of the Intraflagellar Transport Complex 25/27. EMBO J., 30, 1907–1918.
51) Keady, B.T., Samtani, R., Tobita, K., Tsuchya, M., San Agustin, J.T., Follit, J.A., Jonassen, J.A., Subramanian, R., Lo, C.W., & Pazour, G.J. (2012) IFT25 Links the Signal-dependent Movement of Hedgehog Components to Intraflagellar Transport. Dev. Cell, 22, 940–951.
52) Eguether, T., Agustin, J.T.S., Keady, B.T., Jonassen, J.A., Liang, Y., Francis, R., Tobita, K., Johnson, C.A., Abdelhamed, Z.A., Lo, C.W., et al. (2014) IFT27 Links the BBSome to IFT for Maintenance of the Ciliary Signaling Compartment. Dev. Cell, 31, 279–290.
53) Liew, G.M., Ye, F., Nager, A.R., Murphy, J.P., Lee, J.S., Aguiar, M., Breslow, D.K., Gygi, S.P., & Nachury, M.V. (2014) The Intraflagellar Transport Protein IFT27 Promotes BBSome Exit from Cilia through the GTPase ARL6/BBS3. Dev. Cell, 31, 265–278.
54) Taschner, M., Mourão, A., Awasthi, M., Basquin, J., & Lorentzen, E. (2017) Structural Basis of Outer Dynein Arm Intraflagellar Transport by the Transport Adaptor Protein ODA16 and the Intraflagellar Transport Protein IFT46. J. Biol. Chem., 292, 7462–7473.
55) Funabashi, T., Katoh, Y., Michisaka, S., Terada, M., Sugawa, M., & Nakayama, K. (2017) Ciliary Entry of KIF17 Is Dependent on Its Binding to the IFT-B Complex via IFT46-IFT56 as well as on Its Nuclear Localization Signal. Mol. Biol. Cell, 28, 624–633.
56) Nozaki, S., Katoh, Y., Terada, M., Michisaka, S., Funabashi, T., Takahashi, S., Kontani, K., & Nakayama, K. (2017) Regulation of Ciliary Retrograde Protein Trafficking by the Joubert Syndrome Proteins ARL13B and INPP5E. J. Cell Sci., 130, 563–576.
57) Follit, J.A., San Agustin, J.T., Xu, F., Jonassen, J.A., Samtani, R., Lo, C.W., & Pazour, G.J. (2008) The Golgin GMAP210/TRIP11 Anchors IFT20 to the Golgi Complex. PLoS Genet., 4, e1000315.
58) Mukhopadhyay, S., Wen, X., Chih, B., Nelson, C.D., Lane, W.S., Scales, S.J., & Jackson, P.K. (2010) TULP3 Bridges the IFT-A Complex and Membrane Phosphoinositides to Promote Trafficking of G Protein-coupled Receptors into Primary Cilia. Genes Dev., 24, 2180–2193.
59) Badgandi, H.B., Hwang, S.-H., Shimada, I.S., Loriot, E., & Mukhopadhyay, S. (2017) Tubby Family Proteins Are Adapters for Ciliary Trafficking of Integral Membrane Proteins. J. Cell Biol., 216, 743–760.
60) Ye, F., Nager, A.R., & Nachury, M.V. (2018) BBSome Trains Remove Activated GPCRs from Cilia by Enabling Passage through the Transition Zone. J. Cell Biol., 217, 1847–1868.
61) Hirokawa, N., Niwa, S., & Tanaka, Y. (2010) Molecular Motors in Neurons:Transport Mechanisms and Roles in Brain Function, Development, and Disease. Neuron, 68, 610–638.
62) Sung, C.-H. & Leroux, M.R. (2013) The Roles of Evolutionarily Conserved Functional Modules in Cilia-related Trafficking. Nat. Cell Biol., 15, 1387–1397.
63) Takao, D. & Verhey, K.J. (2016) Gated Entry into the Ciliary Compartment. Cell. Mol. Life Sci., 73, 119–127.
64) Yin, X., Takei, Y., Kido, M.A., & Hirokawa, N. (2011) Molecular Motor KIF17 Is Fundamental for Memory and Learning via Differential Support of Synaptic NR2A/2B Levels. Neuron, 70, 310–325.
65) Zhao, C., Omori, Y., Brodowska, K., Kovach, P., & Malicki, J. (2012) Kinesin-2 Family in Vertebrate Ciliogenesis. Proc. Natl. Acad. Sci. USA, 109, 2388–2393.
66) Roberts, A.J., Kon, T., Knight, P.J., Sutoh, K., & Burgess, S.A. (2013) Functions and Mechanics of Dynein Motor Proteins. Nat. Rev. Mol. Cell Biol., 14, 713–726.
67) Asante, D., Stevenson, N.L., & Stephens, D.J. (2014) Subunit Composition of the Human Cytoplasmic Dynein-2 Complex. J. Cell Sci., 127, 4774–4787.
68) Wu, C., Li, J., Peterson, A., Tao, K., & Wang, B. (2017) Loss of Dynein-2 Intermediate Chain Wdr34 Results in Defects in Retrograde Ciliary Protein Trafficking and Hedgehog Signaling in the Mouse. Hum. Mol. Genet., 26, 2386–2397.
69) Nishijima, Y., Hagiya, Y., Kubo, T., Takei, R., Katoh, Y., & Nakayama, K. (2017) RABL2 Interacts with the Intraflagellar Transport-B Complex and CEP19 and Participates in Ciliary Assembly. Mol. Biol. Cell, 28, 1652–1666.
70) Kanie, T., Abbott, K.L., Mooney, N.A., Plowey, E.D., Demeter, J., & Jackson, P.K. (2017) The CEP19-RABL2 GTPase Complex Binds IFT-B to Initiate Intraflagellar Transport at the Ciliary Base. Dev. Cell, 42, 22–36.
71) Chaya, T., Omori, Y., Kuwahara, R., & Furukawa, T. (2014) ICK Is Essential for Cell Type-specific Ciliogenesis and the Regulation of Ciliary Transport. EMBO J., 33, 1227–1242.
72) Lin, Y.-C., Niewiadomski, P., Lin, B., Nakamura, H., Phua, S.C., Jiao, J., Levchenko, A., Inoue, T., Rohatgi, R., & Inoue, T. (2013) Chemically Inducible Diffusion Trap at Cilia Reveals Molecular Sieve-like Barrier. Nat. Chem. Biol., 9, 437–443.
73) Breslow, D.K., Koslover, E.F., Seydel, F., Spakowitz, A.J., & Nachury, M.V. (2013) An in vitro Assay for Entry into Cilia Reveals Unique Properties of the Soluble Diffusion Barrier. J. Cell Biol., 203, 129–147.
74) Shi, X., Garcia, G. 3rd, Van De Weghe, J.C., McGorty, R., Pazour, G.J., Doherty, D., Huang, B., & Reiter, J.F. (2017) Super-resolution Microscopy Reveals that Disruption of Ciliary Transition-zone Architecture Causes Joubert Syndrome. Nat. Cell Biol., 19, 1178–1188.
75) Yang, T.T., Chong, W.M., Wang, W.-J., Mazo, G., Tanos, B., Chen, Z., Tran, T.M.N., Chen, Y.-D., Weng, R.R., Huang, C.-E., et al. (2018) Super-resolution Architecture of Mammalian Centriole Distal Appendages Reveals Distinct Blade and Matrix Functional Components. Nat. Commun., 9, 2023.
76) Chen, F., Tillberg, P.W., & Boyden, E.S. (2015) Expansion Microscopy. Science, 347, 543–548.
77) Tillberg, P.W., Chen, F., Piatkevich, K.D., Zhao, Y., Yu, C.-C.J., English, B.P., Gao, L., Martorell, A., Suk, H.-J., Yoshida, F., et al. (2016) Protein-retention Expansion Microscopy of Cells and Tissues Labeled Using Standard Fluorescent Proteins and Antibodies. Nat. Biotechnol., 34, 987–992.
78) Berbari, N.F., Kin, N.W., Sharma, N., Michaud, E.J., Kesterson, R.A., & Yoder, B.K. (2011) Mutations in Traf3ip1 Reveal Defects in Ciliogenesis, Embryonic Development, and Altered Cell Size Regulation. Dev. Biol., 360, 66–76.
79) Houde, C., Dickinson, R.J., Houtzager, V.M., Cullum, R., Montpetit, R., Metzler, M., Simpson, E.M., Roy, S., Hayden, M.R., Hoodless, P.A., et al. (2006) Hippi Is Essential for Node Cilia Assembly and Sonic Hedgehog Signaling. Dev. Biol., 300, 523–533.
80) Taschner, M., Lorentzen, A., Mourão, A., Collins, T., Freke, G.M., Moulding, D., Basquin, J., Jenkins, D., & Lorentzen, E. (2018) Crystal Structure of Intraflagellar Transport Protein 80 Reveals a Homo-dimer Required for Ciliogenesis. eLife, 7, 929.
81) Huangfu, D., Liu, A., Rakeman, A.S., Murcia, N.S., Niswander, L., & Anderson, K.V. (2003) Hedgehog Signalling in the Mouse Requires Intraflagellar Transport Proteins. Nature, 426, 83–87.
82) Berbari, N.F., Lewis, J.S., Bishop, G.A., Askwith, C.C., & Mykytyn, K. (2008) Bardet-Biedl Syndrome Proteins Are Required for the Localization of G Protein-coupled Receptors to Primary Cilia. Proc. Natl. Acad. Sci. USA, 105, 4242–4246.
83) Zhang, Q., Nishimura, D., Seo, S., Vogel, T., Morgan, D.A., Searby, C., Bugge, K., Stone, E.M., Rahmouni, K., & Sheffield, V.C. (2011) Bardet-Biedl Syndrome 3 (Bbs3) Knockout Mouse Model Reveals Common BBS-associated Phenotypes and Bbs3 Unique Phenotypes. Proc. Natl. Acad. Sci. USA, 108, 20678–20683.
84) Marszalek, J.R., Ruiz-Lozano, P., Roberts, E., Chien, K.R., & Goldstein, L.S. (1999) Situs Inversus and Embryonic Ciliary Morphogenesis Defects in Mouse Mutants Lacking the KIF3A Subunit of Kinesin-II. Proc. Natl. Acad. Sci. USA, 96, 5043–5048.
著者紹介Author Profile
 加藤 洋平(かとう ようへい)
加藤 洋平(かとう ようへい)京都大学大学院薬学研究科生体情報制御学分野助教.博士(薬学).
略歴1979年栃木県に生まれる.2002年筑波大学第2学群生物学類卒.07年京都大学大学院薬学研究科博士課程修了.McGill大学ポストドクトラルフェローを経て,09年より現所属助教.
研究テーマと抱負一次繊毛内のタンパク質輸送のメカニズムとその破綻が引き起こす繊毛病に興味を持って研究を行っている.独自の手法を開発することで新発見を目指したい.
ウェブサイトhttp://www.pharm.kyoto-u.ac.jp/physchem/
趣味読書.実験器具や試薬を自作すること.