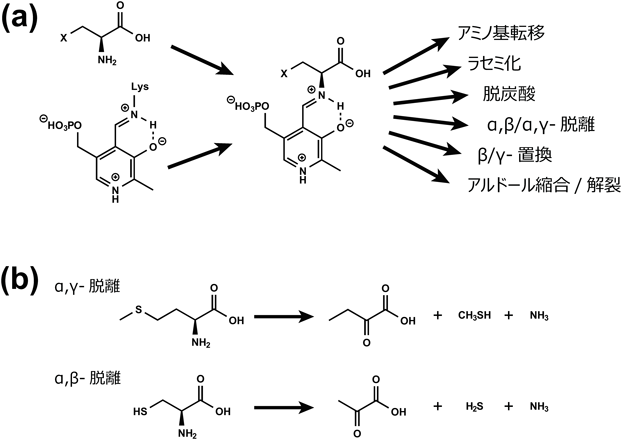
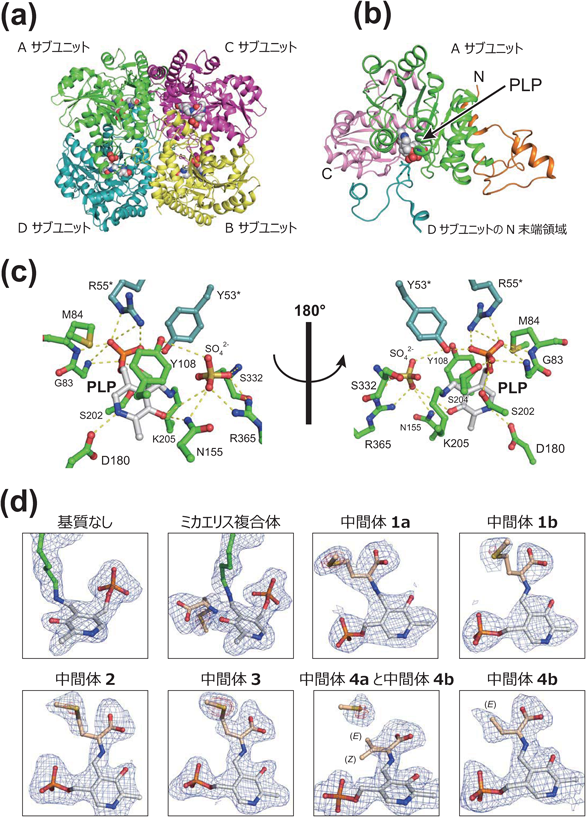
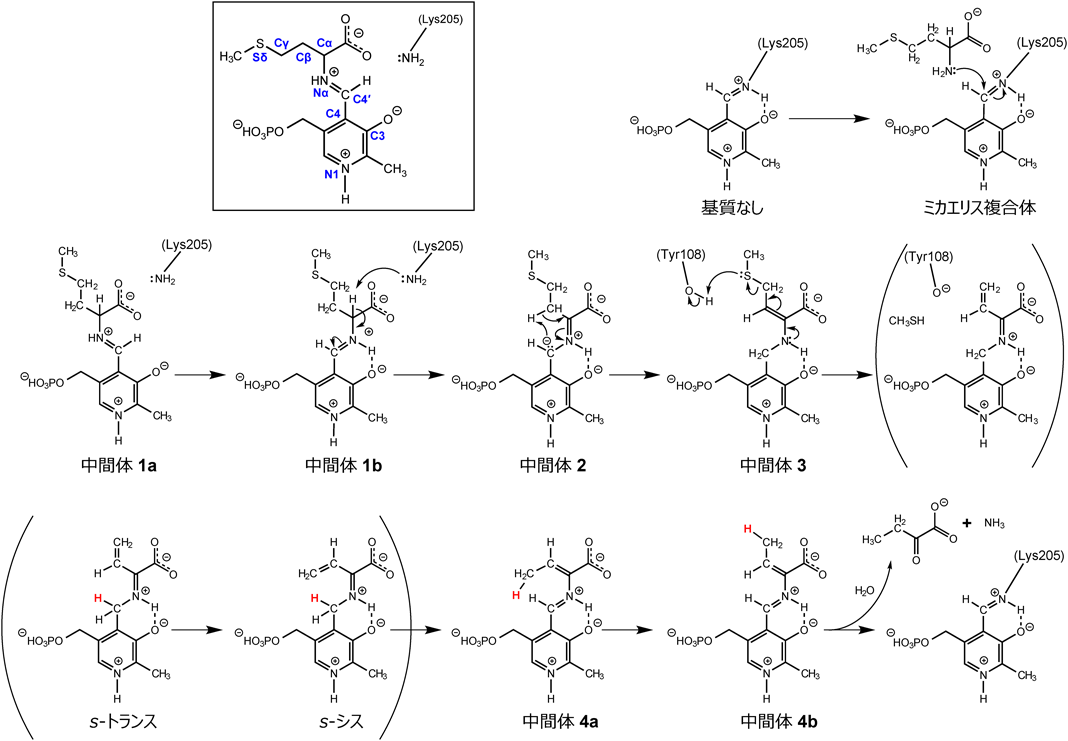
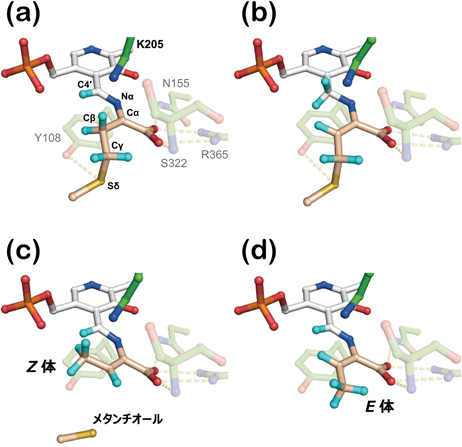
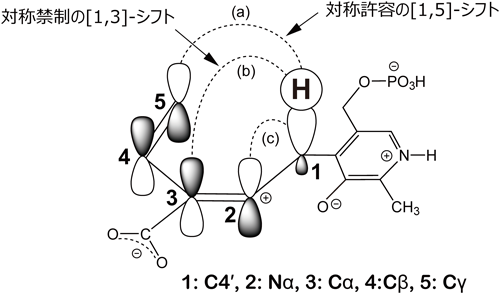
ピリドキサール酵素はシグマトロピー転位の場を提供する——メチオニン分解酵素の反応機構——Pyridoxal enzyme provides an architecture for the sigmatropic rearrangement: the reaction mechanism of methionine degradation enzyme
1 奈良女子大学理学部化学生物環境学科Department of Chemistry, Nara Women’s University ◇ 〒630–8506 奈良県奈良市北魚屋西町 ◇ Kitauoyanishi-machi, Nara 630–8506, Japan
2 京都工芸繊維大学工芸科学部応用生物学域Department of Applied Biology, Kyoto Institute of Technology ◇ 〒606–8585 京都府京都市左京区松ヶ崎御所海道町 ◇ Gosho Kaido-cho, Matsugasaki, Sakyo-ku, Kyoto 606–8585, Japan