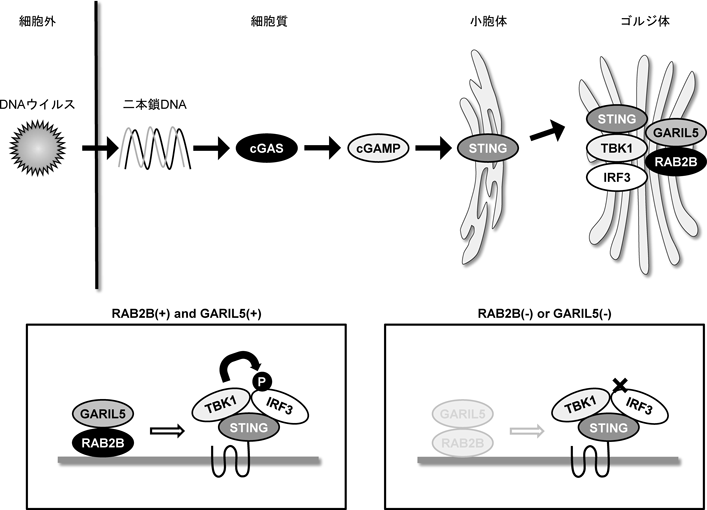
cGASを介した自然免疫応答の制御機序cGAS-mediated innate immunity
1 徳島大学先端酵素学研究所炎症生物学分野Division of Inflammation Biology, Institute for Enzyme Research, Tokushima University ◇ 徳島市蔵本町3–18–15 ◇ 3–18–15 Kuramoto-cho, Tokushima
2 University of Chicago, Institute for Molecular EngineeringUniversity of Chicago, Institute for Molecular Engineering ◇ 900 East 57th Street, Chicago, IL ◇ 900 East 57th Street, Chicago, IL