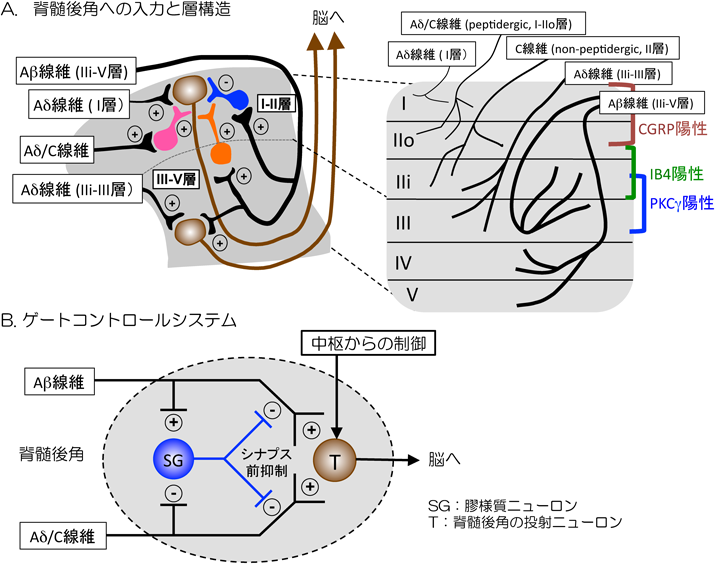
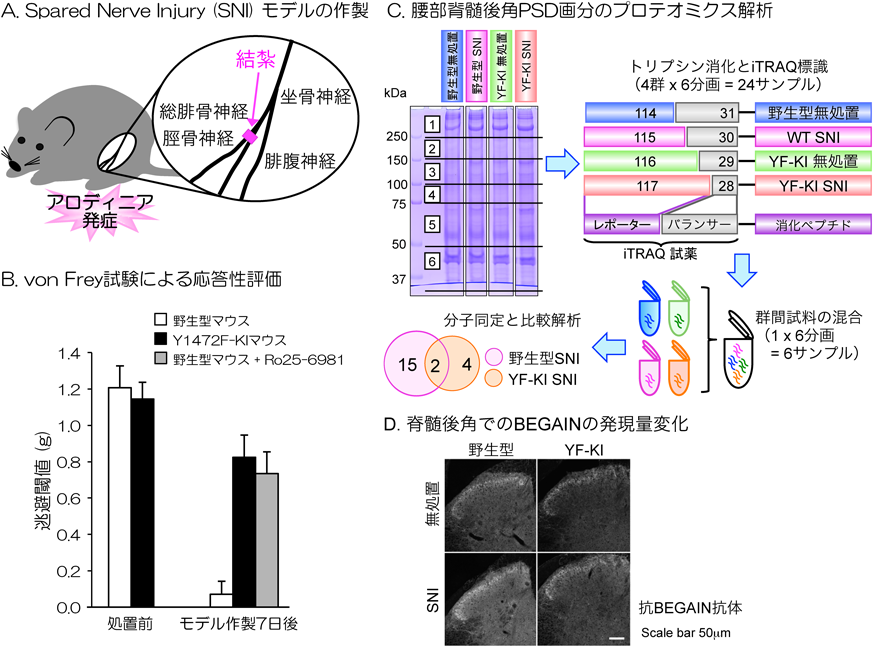
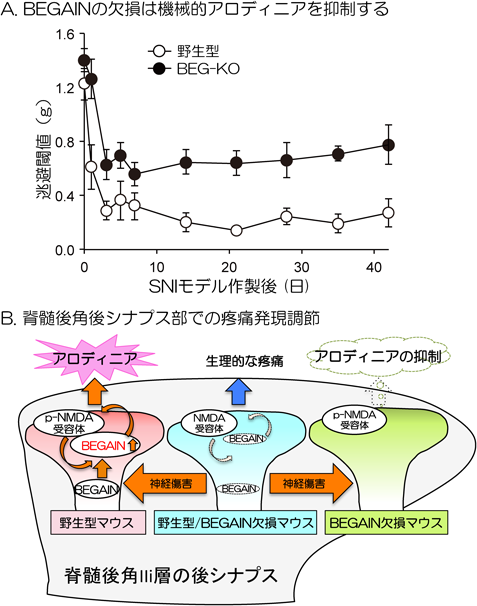
プロテオミクス解析による脊髄後角後シナプス肥厚部からの新規神経障害性疼痛関連分子の同定Proteomic identification of novel neuropathic pain-related proteins in the postsynaptic density (PSD) fraction of the spinal dorsal horn
関西医科大学医化学講座Department of Medical Chemistry, Kansai Medical University ◇ 〒573–1010 大阪府枚方市新町2–5–1 ◇ 2–5–1 Shinmachi, Hirakata, Osaka 573–1010, Japan