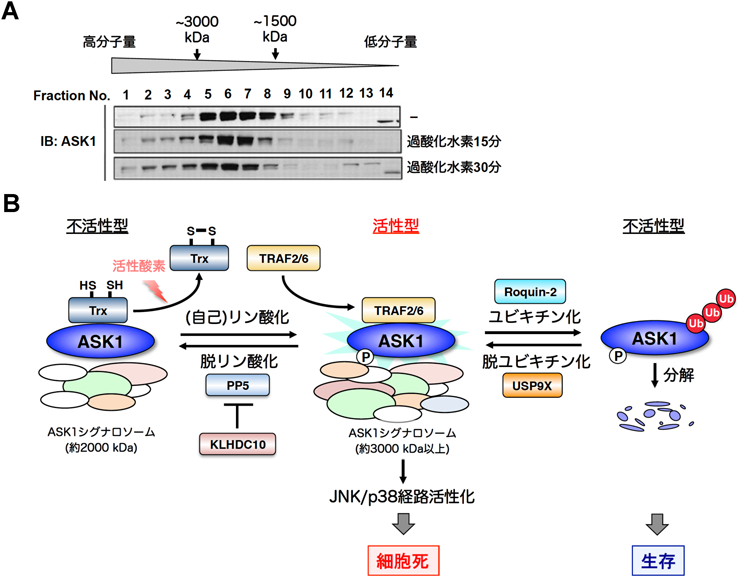
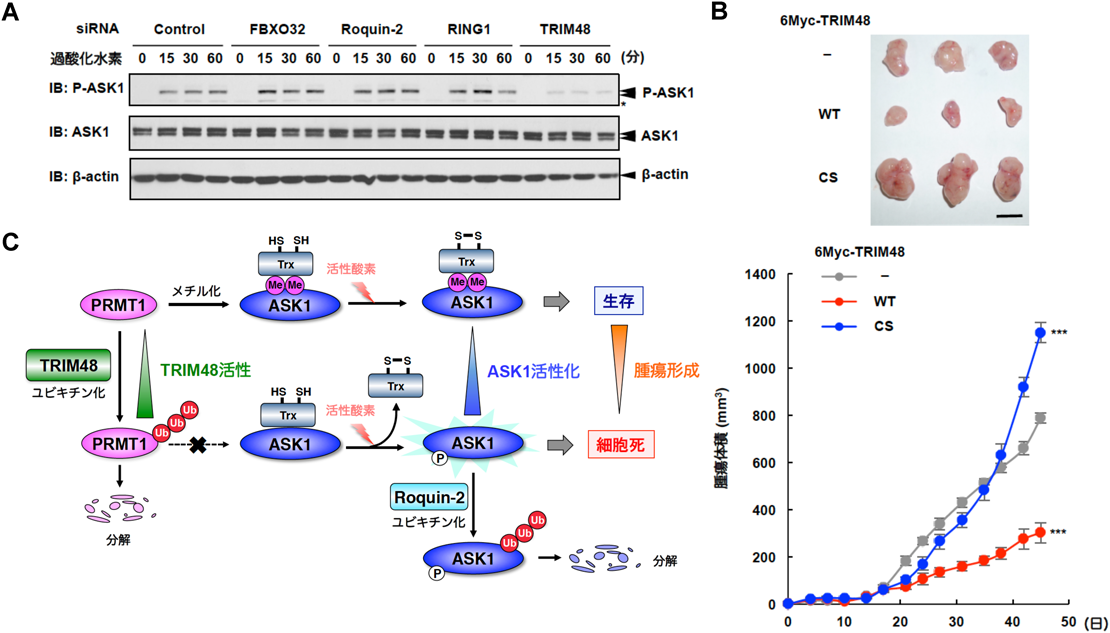
多様な翻訳後修飾を介したストレス応答シグナル伝達の制御機構Regulatory mechanisms of stress-responsive signaling pathways mediated by various types of post-translational modifications
東北大学大学院薬学研究科衛生化学分野Laboratory of Health Chemistry, Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒983–0836 宮城県仙台市青葉区荒巻字青葉6–3 ◇ 6–3 Aoba, Aramaki, Aoba-ku, Sendai, Miyagi, 980–8578, Japan