脳は,いくつもの段階・局面を経て発生する.胎生期においてまず求められるのが,数々の細胞を適切・十分に作るという工程である.この「細胞づくり」工程の活発さ・持続性は,最終産物の構造・機能を裏打ちする.哺乳類の大脳皮質は,最も盛んな「細胞づくり」のおかげで形成される.
新しい細胞の誕生は,親細胞の分裂による.この現象を脳の原基において担うのが神経幹細胞である.細胞内の化学反応・分子制御に対する研究を通じて,細胞周期進行や非対称分裂など,個々の神経幹細胞の振る舞いの仕組みがわかってきた.こうした研究は,がん細胞を含むいろいろな増殖細胞と神経幹細胞との間の共通性,あるいは各種細胞分化系と脳原基との間の類似性をヒントに進められてきた.
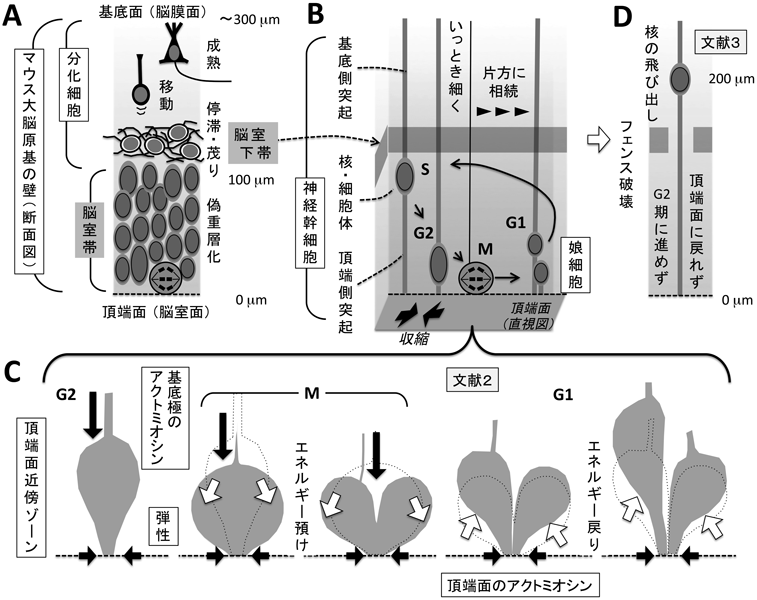
一方神経幹細胞には,自身が脳原基という立体構造の一員としてとる独特のかたちと,それにもとづくユニークな動態がある1).細長い(貝割れ大根やえのき茸のような)からだを利用して,細胞周期依存的に核を上下に反復運動させる.神経幹細胞の多数化・高密度化は,継続的・大規模な脳形成を支えるが,それには集団的核移動の最適化が求められる.ヒト社会における「生産」にとって材料や製品の動き・流れが必須であるのと同様である.核移動遅滞による局所的過剰混雑は,組織構造全体の破綻につながる.最近,集団的核移動の最適化原理を力学的に問うた一連の研究によって,神経幹細胞にとっての物理的外部要因群(=他力,たりき)が「細胞づくり」システムの効率・安全に貢献すると明らかになった2, 3)ので,紹介する.
2. 神経幹細胞の細胞周期依存的核移動:連鎖的化学イベントは「ところ」を変えながら実行される
神経幹細胞はとても細長い(背高の)上皮細胞である.細胞体(核を含む箇所)を除けば1~2 µmの太さしかなく,扁平やサイコロ形の上皮細胞とは大きく見かけが異なるが,脳原基の壁(図1A)の最深部[脳室面,頂端(apical)面]から最浅部[脳膜面,基底(basal)面]までをつないでいるので,上皮細胞の仲間である1).そして,この個性的な細長さは,分裂の場所(脳室面)とDNA複製の場所を離す(胎生期マウス大脳の場合100 µm程度)こと,すなわち細胞周期のG1期に基底方向へ,G2期に頂端方向へ,細い突起の中にめがけて核を進ませる(まるで細長いヘビが,丸呑みした殻つきの大きな卵をお腹の中で動かすかのように)ということに役立てられる(図1B).
細胞周期進行に随伴する核反復は,interkinetic nuclear migration(以下IKNM)と称される(INMとも略される).1935年に脳原基の組織像の観察にもとづいて概念が提唱された4).IKNMは,哺乳類の脳原基において最も盛ん(反復距離が最大)であるが,上皮系全般に起きる普遍的な現象である.脳原基スライス培養下の神経幹細胞IKNMライブ観察5)に加えて,最近では腸管,尿細管,気管などの上皮の核の動きも追跡できる.神経幹細胞の場合,微小管依存的機構(G2期にダイニン依存的に,G1期にキネシン依存的に牽引)およびアクトミオシン(G2期,G1期に核を絞り押し)が核移動に貢献していること,また細胞周期G2期への進行が脳室面向け核移動に必要であることなどが明らかになっている6–9).
3. IKNM範囲・偽重層度の増大による生産規模拡大:大脳原基は「生産物流」研究の好モデル系
核・細胞体の分裂が頂端面で起きるのは上皮全般に共通である.染色体分離作業を微小管によって行おうとするなら,一次繊毛の基部にある中心体・基底小体のそばでM期を迎えるのが合理的で,背高上皮の神経幹細胞も,このメリットを共有するようだ1, 6, 7).では,非M期の核・細胞体をわざと頂端面以外の場所(基底側の場所)で過ごさせること(IKNM)には,どんな意義があるだろうか.ヒト社会においては,工場を製品づくり専用スペースとする(材料仕込みは別場所で行い,生じた製品を決して置きっぱなしにせず,すぐ運び出す)ことが生産規模拡大につながるという「生産物流」戦略(常識)がある.これとのアナロジーをもって,IKNMには,分裂準備(非M)期間の核を「奥」に控えさせることで,単位頂端面あたりの細胞づくりの頻度を増す役目・効能があると考えられている1, 6, 7).
一つの頂端面生まれ娘細胞に,細胞周期を進行させながら,DNA複製終了地点を折り返し点としてブーメランのように戻って来させ,分裂という生産作業を行わせるという現象(図1B)は,一筋のヘアピンループ状「生産ライン」とみなすことができる.そして無数の「生産ライン」が水平方向に束ね合わされて,脳原基の脳室帯(ventricular zone:VZ)という組織構造が成立している(図1A).どの「生産ライン」もブーメラン射程距離は同じだが,開始時間がまちまちである(脳原基の頂端面に向かって連続ライブ観察すると,面のあちこち,ランダムな場所で次々に神経幹細胞の分裂がみえる10)).したがって,組織を任意のタイミングで断面視・俯瞰すると,頂端面スタートからのいろいろな経過時間・移動距離にある核・細胞体たちが,頂端–基底軸上に何層にも密に積み重なってみえる(図1A,神経幹細胞のからだ全体としては単層なので,「偽重層」と称される).正常・生理的状況では,核・細胞体が一度に頂端面に殺到したり,逆に頂端面近傍に不在となるなどは起こりえず,核・細胞体の「積み重なり」の間隔は一定であり,秩序だった組織様態を呈する1, 6, 7).
「生産ライン」(IKNM)の射程距離を増して束ねることが大規模な細胞づくりに貢献すると,偽重層度の高い哺乳類の脳原基からみてとれる.したがって,哺乳類の脳原基は,発生中の器官における「生産物流」を効率・安全に注目してシステム的に研究する格好の対象・モデル系である.また,大脳皮質原基の脳室帯の厚さ・偽重層度は「マウス<ヒト」なので,脳の進化を「生産物流」の観点から問うこともできるかもしれない1).
4. 「生産物流」の効率・安全のための工夫1:基底側突起を利用した「時差出勤」
頂端面で誕生した娘細胞の核・細胞体が速やかに基底方向へ出ていかないと,頂端面近傍ゾーンが過剰混雑に至り,神経幹細胞は,頂端面から離脱する(逃げ出す)10).これは,神経幹細胞自身にとっては生存のための対処行動であるが,組織秩序の破綻に至る病的事態である.この離脱現象をもたらす機構の詳細は依然不明であるが,過剰な力学的負荷(組織内残留応力解放試験によって把握された)が引き金となっているのはほぼ間違いないので,その感知から細胞内シグナル伝達を介して離脱の実行に至るまでの一連の過程の分子レベルでの解明が待たれる.「細胞競合」にあずかる機構群11)との関わりも注目される.
実は,ここで述べた「基底方向への核・細胞体の出の不達成」は,実験的に神経幹細胞から基底側突起を奪うことによってもたらされた[細胞表面分子TAG-1(contactin 2)のノックダウン実験]10).本来は,基底側突起が親細胞から二つの娘細胞のうちの片方のみに相続されることで,片方の核・細胞体を先に,もう片方(非相続)のをあとに,という「時差出勤」風の送り出しが成立している(図1B)5, 10).基底側突起の一子相伝的譲り渡しは,優先搭乗券のような整流(ボトルネックのリスクを軽減する)効果を通じて効率的かつ安全な集団的核移動に貢献している1).
5. 「生産物流」の効率・安全のための工夫2:「他力」利用
1)脳室帯における生理的混雑,弾性の活用
前述のように,核・細胞体(特に去るべきG1期細胞の核・細胞体)の過剰混雑・渋滞は,頂端面近傍ゾーンにおいてG2期細胞,M期細胞の居心地を悪くさせ(異常な脱出・離脱に至らせ),神経幹細胞集団にとって危険である1, 10).しかし,最近の研究で,生理的な範囲であれば,細胞密集化(crowding)およびそれがもたらす力学的負荷が神経幹細胞集団にとって大変重要であることもわかってきた2).
核・細胞体が基底方向へうまく動き去ったあとの頂端側突起1本1本は,殻つき卵を呑み込んでいないヘビのように細長く,かさばらない(図1B).そのような柔軟で曲げやすそうな突起群が多く密に集められれば,頂端面近傍ゾーンに適度な圧縮状態そして弾性が生まれる(図1C)2).頂端側突起群を束ね合わせ,適度な圧縮・弾性を当該ゾーンにもたらす原動力は,頂端面の接着結合部位におけるアクトミオシン作用による求心的収縮である(図1B, C)2, 10).したがって,何かを弾ませうる力は,頂端面からその近傍において最強で,奥(基底側)に向けて弱くなる.この生理的圧縮気味で弾性に富む頂端面近傍ゾーンにおいて,神経幹細胞は分裂期に入ると,G2期まで頂端–基底軸に沿って紡錘形をしていた細胞体を,その基底極にアクトミオシンを集めて絞り下ろすことによって,球状にする(図1C)2, 7, 9).ライブ観察の結果から,以下のような力学的なメカニズムが予想された.すなわち,丸まりの際に,分裂期幹細胞は周囲に林立する頂端側突起群を側方に押し,そこに弾性エネルギーがしばし蓄えられる(図1C).分裂の終了後,そのエネルギーは,求心的かつやや基底向きに戻り,誕生した娘細胞(基底側突起相続・非相続にかかわらず,両方の娘細胞)の核・細胞体に与えられ,その基底方向への初動(10 µm程度)を助ける2).
各種力学的実験(頂端面近傍ゾーンにおいてM期の細胞体をレーザーでつぶすと周囲の頂端側突起群が求心的に攻め寄せる,アクトミオシンを阻害すると分裂期細胞体が基底方向に異常変位してしまう,頂端面近傍ゾーン全体に対する側方からの加圧で娘細胞初動が早まり,誕生したての娘細胞核の周囲の除圧がその初動を鈍らせる,など),数理シミュレーション(バネ定数を変えるin silicoテストを含む)およびフィジカルなシミュレーション(多数のゴムチューブの端を密に束ねた上で,その束の中に包み入れたピンポン玉を端にめがけて押しつけると,端箇所の弾性によってピンポン玉が押し戻される)のいずれもが,このモデルを支持した2).さらに,実測した全脳室帯細胞核の挙動を再現した数理シミュレーション(バーチャル脳室帯)によって,この「初動」が集団的IKNM全体(偽重層構造の維持)に対して不可欠と示された2).
実は神経幹細胞の集団的核移動に受動的なしくみが関与するだろうとの提唱が以前からあった8, 9)が,その実情(力が,どこからどこへ,どう伝えられるか)は不明であった.今回の研究によって,具体的メカニズムとしての弾性の意義,間接的「親→子」ギフトが示された2).弾性利用は,昆虫のはばたき(飛翔筋を助けるレシリン),四足動物の走行(足底アーチの腱・靱帯),心臓からの送血(大動脈によるwindkessel効果)などの例のように,エネルギー消費的な力発生機構とうまく組み合わさることで,システムレベルの省エネに自然界のいたるところで貢献している2).細胞間の力学的な協同の一例として,(わかってみれば)至極当然のように思える.
さらに,M期細胞と非M期細胞の間には,従来知られてきた時間軸上の関係性,すなわちそれぞれがもう一方になる・移行するというproducer–productの関係および化学反応の進行順に加えて,同時刻に空間的な隣接性にもとづいて実現する力学的な協同関係があることもわかった.しかもこの協同は,「G1期細胞の立ち退きが頂端面近傍ゾーンを次のM期細胞に空け渡す(前述)」⇔「M期細胞の丸まりが,子細胞としてのG1期細胞の初動を助ける」と,相互扶助的である(生態学概念の「共生」に相当).脳室帯が,力学的「共生」に満ちた「生態系」にみえてきた2).
2)脳室帯での細胞づくりをメカニカルに支えるフェンスとしての脳室下帯
M期細胞と非M期細胞の関わり合いについて前述した細胞間の「力学的協同」は,脳室帯とその外にある脳室下帯の関係としても成り立つことが,別の研究によってわかった.胎生中期マウスの大脳原基の壁は200~300 µm程度の厚さがある.一方脳室帯は100 µm厚である(図1A).これは,200~300 µm長の神経幹細胞(放射状グリアとも称される)のIKNMの折り返し点(最も基底側の到達点)が100 µmであることを意味する(図1B)1, 6).実は,どうやってこの「100 µm IKNM折り返し」が果たされているか不明であった.一つの考え方は,個々の神経幹細胞が基底方向に核を動かした距離または(および)時間を測っており,自身で折り返しを決めるというものである.しかし,頂端面近傍ゾーンを最強とする組織圧縮(前述)は,大脳原基壁の最内部から外向けに押し出す力を想像させる.そこで,もしかしたら,外向けに押し気味・膨張気味な脳室帯(神経幹細胞とその娘細胞の核・細胞体の集団)を外から内に向けて押し戻す力が働いているのではないかと想像した.そして,ニューロンおよび中間(非幹細胞的)前駆細胞が密に集積することで知られる脳室下帯(図1A, B)12–14)の力学的(フェンス・バリアとしての)貢献を問うことにした3).
胎生期に脳室下帯細胞のみを急性除去(子宮内電気穿孔法でジフテリア毒素遺伝子を導入して行う)すると,翌日には「穴のあいた脳室下帯」のなかに幹細胞の核・細胞体が多数観察された3).毒素を用いる代わりに分化途上細胞の突起を短くして15),脳室下帯に本来の複雑な茂みのような様態をとらせない実験を行っても,幹細胞の核・細胞体の飛び出し・オーバーシュートが再現された3).さらに翌日には,より基底側のゾーンにまで幹細胞の核・細胞体が達してしまっていた.個々の幹細胞の形態を調べると,脳室面につながったまま,200 µmという本来はありえないような過長な頂端側突起を有していた(図1D)3).こうした頂端側突起過長な(核・細胞体が外・基底方向へ飛び出した)幹細胞は,頂端方向への核移動ができず,また細胞周期がS期でアレスト(またはきわめて遅延)しているとわかった3)(Fucciマウス由来のスライス培養,BrdUによる標識を組み合わせた).
これらの結果から,個々のIKNMの基底側での折り返しには脳室下帯のフェンス機構が必要であること,そしてこのメカニカルな助けなしでは,頂端面での分裂という神経幹細胞の役割が果たせないことがわかった.まるで鍋底から起こる対流を受け止め,具材の飛び出しを防ぎ,料理を成功させる「落としぶた」のように,脳室下帯には脳室帯における細胞づくりを成功させる力学的な役目がある.