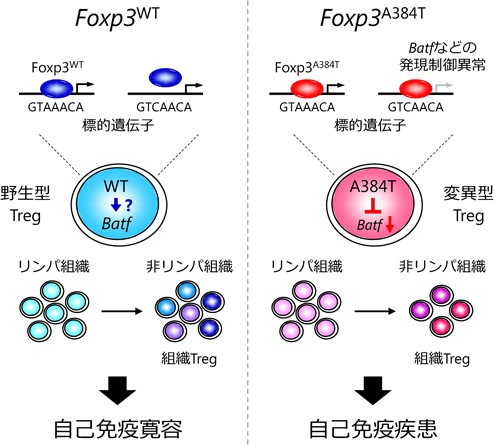
Foxp3変異体の機能解析から明らかになった,制御性T細胞における転写因子BATFの重要な役割Analyses of a Foxp3 mutant reveal a critical role of the transcription factor BATF in regulatory T cell function
東京大学大学院薬学系研究科免疫・微生物学教室Laboratory of Immunology and Microbiology, Graduate School of Pharmaceutical Sciences, The University of Tokyo ◇ 〒113–0033東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan