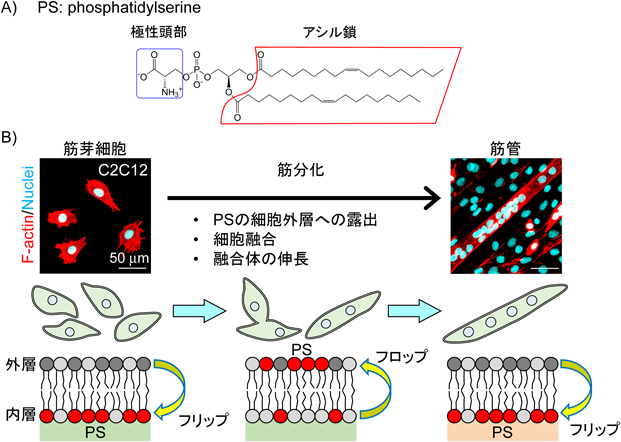
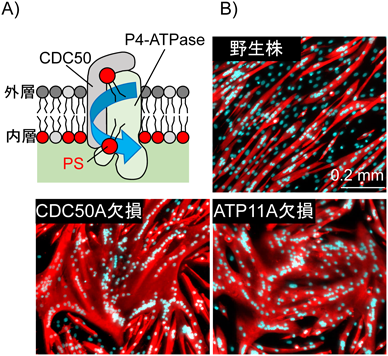
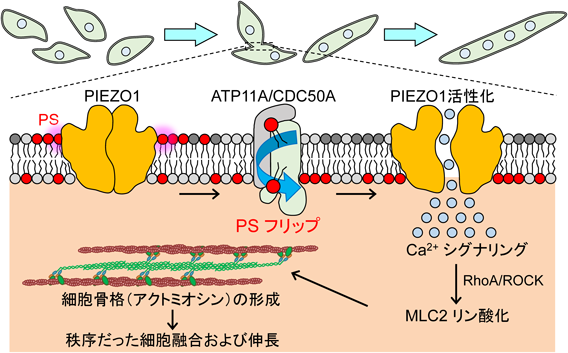
ホスファチジルセリンのフリップ・フロップによる筋管形成制御Cell surface flip-flop of phosphatidylserine is critical for PIEZO1-mediated myotube formation
京都大学大学院工学研究科合成・生物化学専攻生体認識化学分野Department of Synthetic Chemistry and Biological Chemistry, Graduate School of Engineering, Kyoto University ◇ 〒615–8510 京都府京都市西京区京都大学桂 ◇ Kyotodaigaku-Katsura, Nishikyo-ku, Kyoto 615–8510, Japan