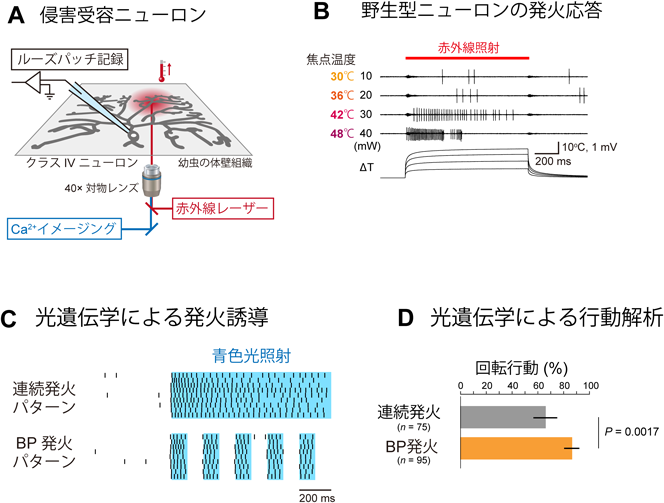
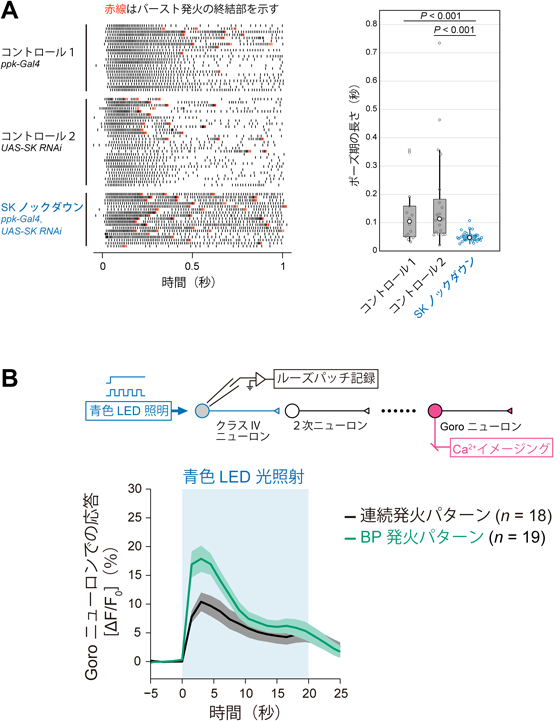
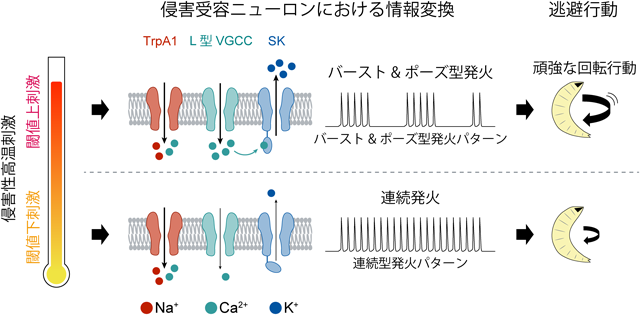
個体の逃避行動を制御するメカニズム:感覚ニューロンのイニシアティブRegulatory mechanism of escape behavior: Initiatives of sensory neurons
京都大学大学院生命科学研究科統合生命科学専攻細胞認識学分野Graduate School of Biostudies, Kyoto University ◇ 〒606–8501 京都市左京区吉田近衛町京都大学医学部構内G棟123号室 ◇ South Campus Research Building (Building G) Room 123, Kyoto University; Yoshida Konoe-cho, Sakyo-ku, Kyoto 606–8501