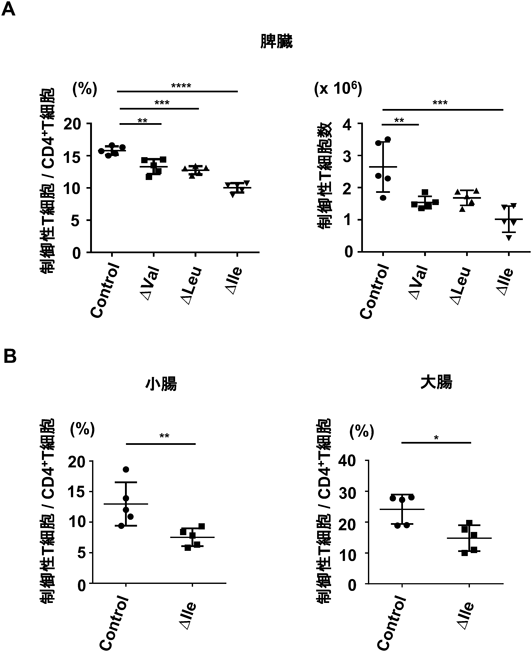
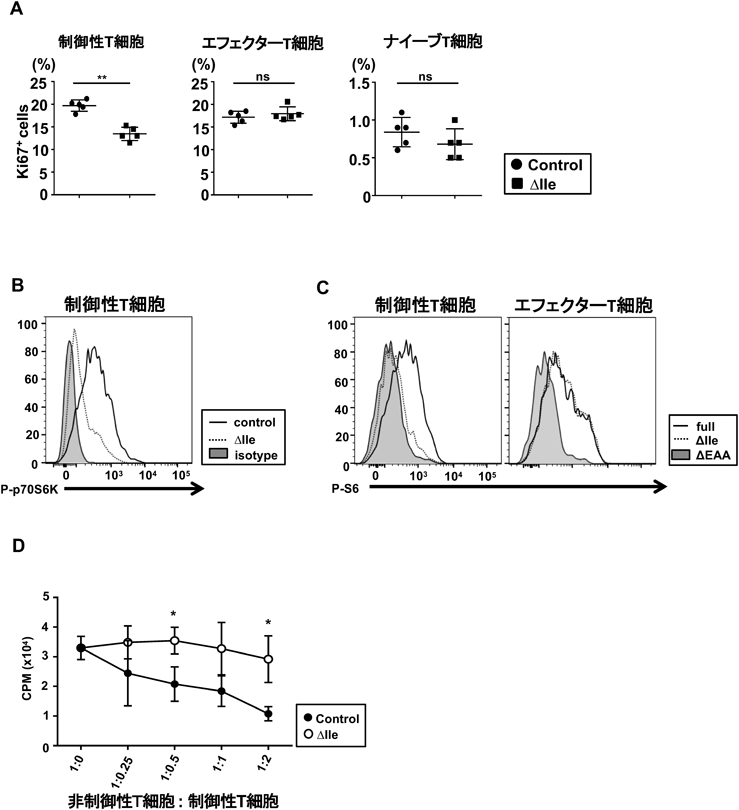
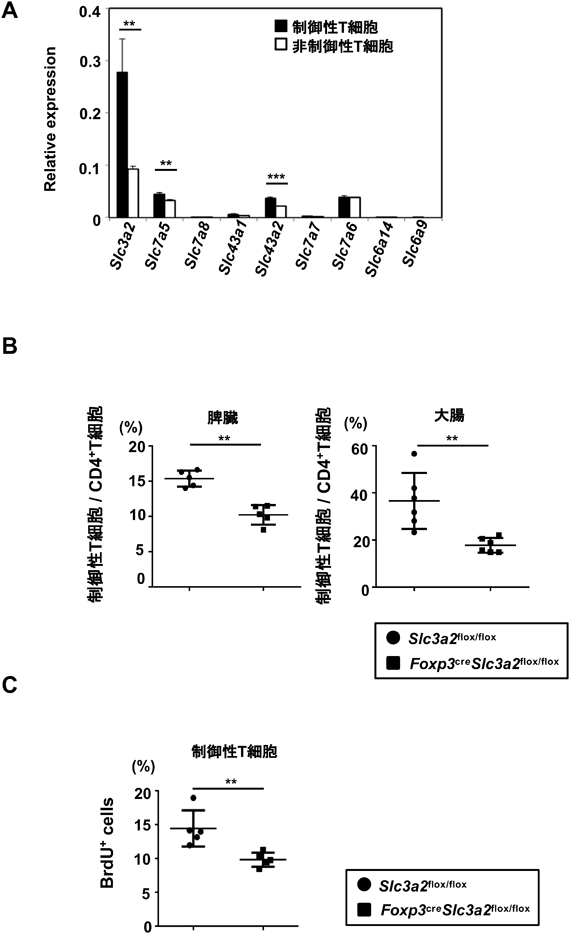
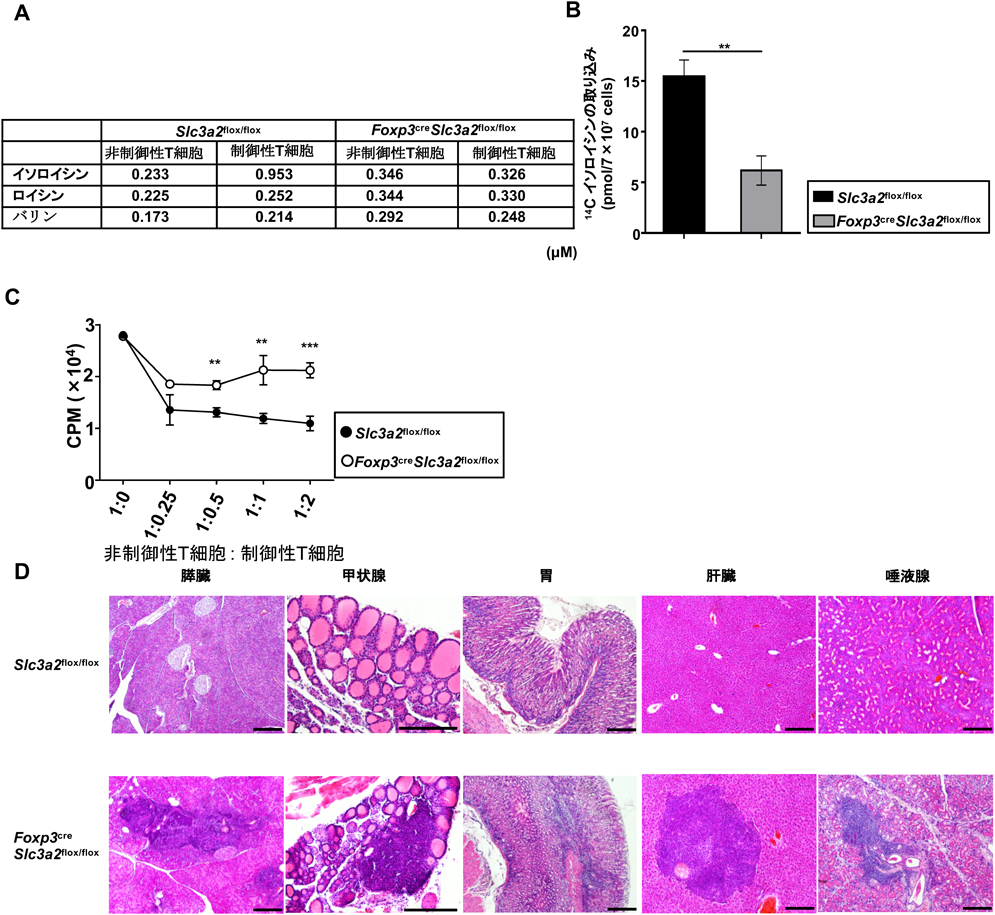
分枝鎖アミノ酸による制御性T細胞の維持Branched-Chain Amino-Acid-Dependent Maintenance of Regulatory T Cells
1 大阪大学大学院医学系研究科感染症・免疫学講座免疫制御学Laboratory of Immune Regulation, Department of Microbiology and Immunology, Graduate School of Medicine, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ Yamada-oka, Suita, Osaka 565–0871, Japan
2 東京大学大学院医学系研究科社会連携講座糖尿病・生活習慣病予防講座 ◇ 〒113–8655 東京都文京区本郷7–3–1 ◇ Department of Prevention of Diabetes and Lifestyle-Related Diseases, Graduate School of Medicine, The University of Tokyo