近年,環境からの刺激は,エピゲノム(DNAやヒストンのメチル化などの化学修飾)としてゲノムに記録され,細胞分裂を繰り返しても保存される一個体の細胞の記憶システムを形成していることが解明されつつある.エピゲノムは環境の変化に伴い,塩基配列を変えず,遺伝子発現を変える環境への適応機構そのものである.これに加え,クロマチン3次元構造変化は遠隔のエンハンサーをプロモーターに近接させ,細胞特異的な遺伝子発現に関与する.寒冷環境は我々の生命を脅かしうる脅威でもあり,迅速な応答とともに場合によっては長期寒冷の適応も必要となってくる.本稿では,エピゲノムとクロマチン高次構造変化を介して急性と慢性の寒冷刺激に応答そして適応していく仕組みについて,我々が取り組んでいるヒストン脱メチル化酵素の役割を介する.
2. βARシグナル伝達と熱産生細胞による適応型熱産生
1)褐色脂肪細胞
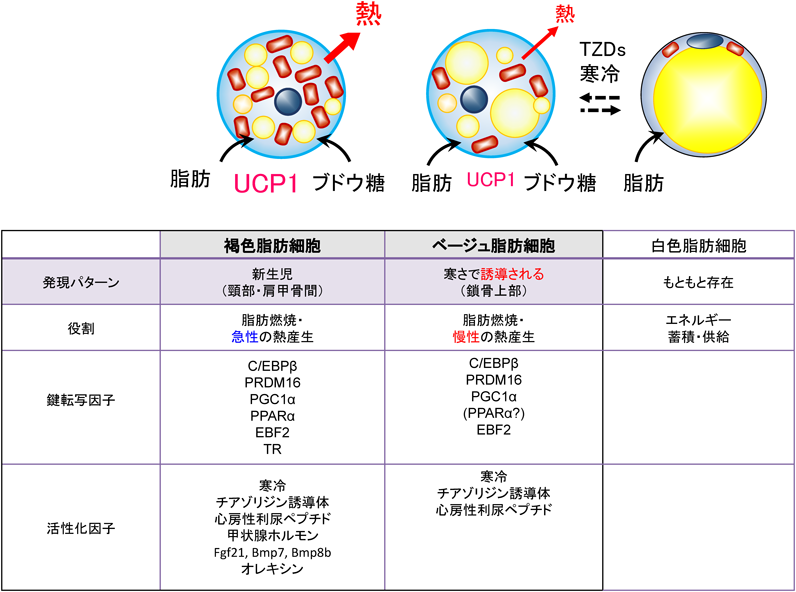
寒冷環境は生命を脅かすストレスである.この寒冷環境に対して,恒温動物は二つの異なるタイプの脂肪細胞,褐色脂肪細胞とベージュ脂肪細胞,が熱を産生し体温の維持に寄与する(図1).一つめの褐色脂肪細胞は,個体が寒冷ストレスを感知すると急性応答として熱を産生し,骨格筋の震えによる熱発生とともに体温維持に重要な役割を果たす.ミトコンドリア内膜の脱共役タンパク質UCP1は,非ふるえ性熱産生を媒介するために,褐色脂肪細胞において特異的に発現し,電子伝達系で産生されるプロトン勾配を利用して,ATP産生の代わりに熱産生を行う1).褐色脂肪細胞は新生児や冬眠動物で特に多く,新生児では肩甲骨間に,成人においては鎖骨上部に多く存在する(こちらはベージュ細胞との考え方もある).新生児は,母体の中にいるときとは異なり外気にさらされるため,自ら体温を維持する必要がある.マウスでは,生まれる数日前から褐色脂肪細胞でUCP1タンパク質の発現が誘導される.
現在までのほとんどの研究は,褐色脂肪細胞のUcp1 mRNAの特異的発現を制御する調節機構に主に焦点を当ててきた.褐色脂肪細胞は,Ucp1 mRNAおよびタンパク質を恒常的に発現することによって基礎熱産生を維持する.Ucp1発現誘導は,βアドレナリン受容体(AR)シグナル伝達経路における転写因子および補助活性化因子のリン酸化によって媒介される.βAR下流のプロテインキナーゼA(PKA)は,転写因子CREB(cAMP応答エレメント結合タンパク質)をリン酸化する2)(総説3)で概説).PKAはまた,転写因子ATF2および転写補助活性化因子PGC1αのp38/MAPK介在リン酸化を促進する4, 5).PGC1αは,ミトコンドリアの造成,エネルギー消費,およびPPARγの転写補助活性化因子としての熱発生(たとえば,Ucp1)に関与する遺伝子の発現を調節する6, 7).ゲノムワイドのmRNA発現解析により,褐色脂肪細胞のβARシグナリングの活性化後60分で,熱産生に関連する約70の遺伝子発現が増加することが判明している8).したがって,βARシグナル伝達,下流の転写因子および補助活性化因子は,褐色脂肪細胞における急性寒冷ストレス時の熱産生遺伝子の迅速な誘導を媒介する.
2)ベージュ脂肪細胞
体温維持に重要な二つめの細胞はベージュ脂肪細胞と呼ばれる細胞である.これは生まれながらに備わっているものでははく,慢性的な寒冷環境刺激によって皮下白色脂肪組織(scWAT)中に誘導され,褐色脂肪細胞同様に熱を産生する脂肪細胞である(図1).寒冷環境が慢性的に持続すると,scWATはベージュ脂肪細胞に大きく置き換わる.このscWATの質の変化・リモデリングをベージュ化という.ベージュ化は今日,核内受容体PPARγの合成アゴニスト,心房性利尿ホルモン,Fgf21など他の刺激でも誘導されることが知られている9, 10).
我々ヒトの生命の設計図である30億塩基対からなるゲノムDNAのうち,どの遺伝子DNAが実際に機能してRNAに転写されるのかを決める仕組みが必要である.この仕組みがエピゲノム機構である.ヒト二倍体細胞に納められているDNAの総延長はおよそ2 mに達する.これが直径約10 µmの核にクロマチンとして収納される.クロマチンを構築する基本構造はヌクレオソームと呼ばれる構造で,これは八量体からなるヒストンタンパク質にDNAが約1.65回巻きついた構造である.ヌクレオソームがアレイ状につながり,電子顕微鏡的には「ビーズに糸を通した構造」をとる.これをさらに巨視的にながめた場合,クロマチンは凝集の度合いによりヘテロクロマチンとユークロマチンに分類される.遺伝子発現が抑制されている領域は,強く折りたたまれてヘテロクロマチンを形成する.
ヌクレオソーム構造のそれぞれのコアヒストンは球形のカルボキシ末端と,決まった構造をとらないアミノ末端(ヒストン尾部)から構成されている.ヒストン尾部はアセチル化,メチル化,リン酸化,ユビキチン化といったさまざまな化学修飾を受けることにより,遺伝子発現の制御に関わる.ヒストンのアセチル化は遺伝子の発現を活性化させ,脱アセチル化は遺伝子の発現を抑制するという単純な方向性とは異なり,ヒストンのリジンのメチル化は複雑である.リジンメチル基転移酵素によってリジンはモノ,ジ,トリメチルと3個までメチル化されうる.そしてメチル化の数とメチル化されるヒストン尾部のリジンもしくはアルギニン残基の位置によって,遺伝子発現に対し「抑制」と「活性化」のどちらに関与するかが異なる.また,これらの修飾により,遺伝子のエンハンサー,遺伝子本体(エキソン–イントロン)の転写状態など遺伝子の活動状態が解読できる.たとえば,ヒストンH3のN末端から27番目のリジンのアセチル化(H3K27acと表示)修飾は,活性化したエンハンサーのしるしである.後述するクロマチンの3次元構造により,活性化エンハンサーは細胞特異的遺伝子発現の決定に大きく関与する.ヒストンH3の4番目のリジン(H3K4)がモノメチル化(H3K4me1)修飾されているDNA領域は,活性化していない準備状態のエンハンサーを示す.一方,H3K4トリメチル化(H3K4me3)は活性化している遺伝子転写開始点にみられ,エンハンサーには認められない.これに対して,ヒストンH3の9番目のリジンのジ,トリメチル化(H3K9me2, H3K9me3)およびH3K27のトリメチル化(H3K27me3)は,ヘテロクロマチンを形成するなどしてDNAの転写を抑制するヒストン修飾である.
4. ヒストン脱メチル化酵素JMJD1A(KDM3A)
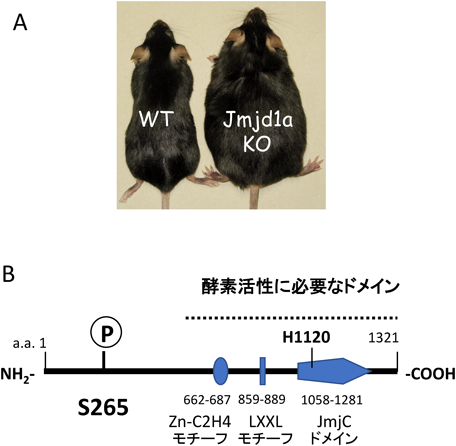
JMJD1AはJumonjiドメインを含むファミリーメンバーに属するヒストン脱メチル化酵素である.H3K9me1, H3K9me2のメチル基を消去することによって遺伝子の発現抑制を解除し,転写を誘導する.精子形成や性決定,低酸素での応答,がんなどに関わることが知られている.我々はJMJD1Aノックアウト(KO)マウスの解析を行ったところ,KOマウスが通常食下においても肥満を呈し(図2A),高血糖,高インスリン血症,高脂血症などの代謝異常を伴うことを見いだした.そして,寒冷刺激において野生型と比べ低体温となり,適応型熱産生の低下があることが認められた8, 11).適応型熱産生の低下は肥満の原因の一つを担う.褐色脂肪細胞のβAR刺激時にJMJD1Aは熱産生に関与するUcp1やAdrb1(β1-ARの遺伝子名),Pgc1a, Pparaなど約40以上の遺伝子を標的とすることをJMJD1Aのクロマチン免疫沈降後の次世代シーケンサー解析(ChIPシーケンシング解析)から見いだした8).
1)JMJD1AのβAR刺激によるリン酸化
適応型熱産生には,寒冷刺激に伴う交感神経系活性化による褐色脂肪細胞膜上のβアドレナリン受容体(βAR)刺激と,その下流の細胞内シグナル伝達が重要である.βARの非選択性アゴニスト,イソプロテレノール(ISO)を処理した細胞のライゼートから,ヒトJMJD1A抗体で免疫沈降し,質量分析の結果から265番目のセリン(Ser265)がリン酸化することを見いだした(図2B).この部位のリン酸化抗体を作製したところ,実際に細胞内でβAR刺激依存的にリン酸化し,PKAの阻害薬によってこれが阻害された.
しかし,JMJD1AのSer265のリン酸化はin vitroの脱メチル化酵素活性には影響しなかった.それではこのリン酸化は遺伝子発現に影響するのか? そこで次のような実験系を構築した8).マウス由来の不死化した培養褐色脂肪細胞発現する内在性のJMJD1AをshRNAによってノックダウンしたのち,ヒトの野生型もしくは各種変異体JMJD1Aをレトロウイルスによって安定的に発現させた細胞株を作製し,分化誘導ののちISOにて刺激し,時系列でUcp1とAdrb1の発現を解析した.
この解析からSer265をアラニンに変異(S265A)させた発現細胞ではUcp1などのmRNAの発現は顕著に抑制されることから,Ser265のリン酸化がUcp1やAdrb1などの熱産生遺伝子発現に必須なことが明らかとなった.さて,JMJD1Aのヒストン脱メチル化活性には活性中心の1120番目のヒスチジンが重要である.これを他のアミノ酸に置換すると活性は消失する.しかし,これをチロシン(Y)やフェニルアラニン(F)に変異させたJMJD1Aの発現細胞でも野生型同様にこれらの遺伝子の発現が誘導されることから,褐色脂肪細胞でのUcp1の遺伝子発現に脱メチル化活性が不要であることが判明した.
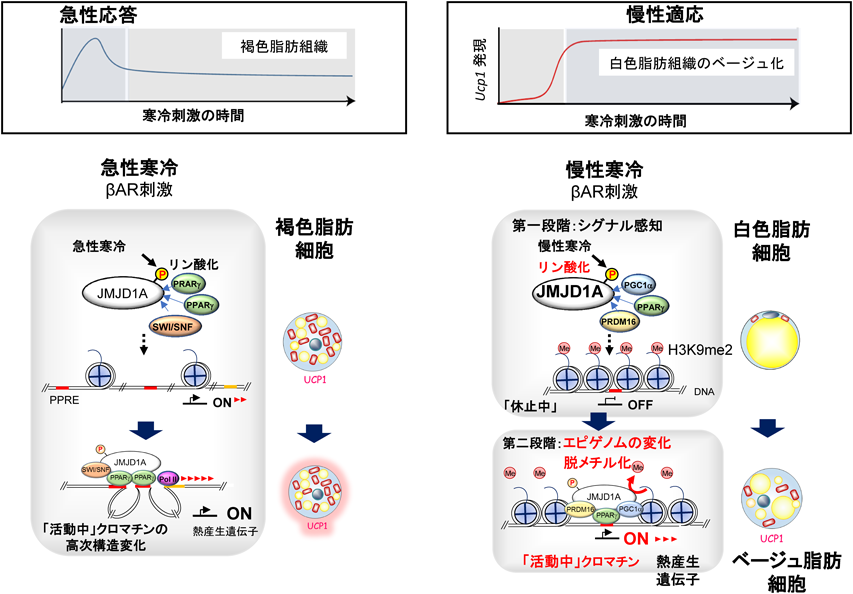
マウスの褐色脂肪組織から抽出したヒストンのイムノブロット解析ではヒストン中の総H3K9me2量は,白色脂肪細胞のそれと比べるとはるかに低く,数時間レベルでの寒冷刺激やISO刺激でこれがさらに減少することもなかった.このことより,短時間(<数時間)の交感神経刺激による褐色脂肪細胞における熱産生遺伝子(Ucp1やAdrb1など)の発現にはJMJD1AのSer265のPKAのリン酸化が必要である,しかし,ここに脱メチル化活性は必要ではない,と結論づけた(図3左)8).
2)リン酸化JMJD1A-SWI/SNFクロマチン再構成因子-PPARγタンパク質複合体
それではどのようにしてβAR刺激依存的にJMJD1Aは特異的な遺伝子発現を制御するのだろうか? 我々は質量分析を用いタンパク質複合体解析を行った.その結果,JMJD1Aはリン酸化依存的に,SWI/SNFクロマチン再構成因子および核内受容体PPARγとタンパク質複合体を形成することを発見した.SWI/SNFクロマチン再構成因子はATPase活性を有し,DNAとヒストンの結合を壊し,DNAの転写因子結合部位を露出させる.そこに転写因子が結合することによって転写が亢進する.SWI/SNFタンパク質複合体の構成タンパク質であるBRG1やARID1AをノックダウンするとUcp1やAdrb1などの熱産生遺伝子の発現は抑制され,さらにβAR刺激依存的な発現も抑制された.このことから,リン酸化されたJMJD1AがUcp1などの転写を亢進させるメカニズムの一つを担っていることが見いだされた.さらにJMJD1AのChIPシーケンスのDNA結合モチーフ解析ではPPARやC/EBPそして熱産生誘導転写因子EBF2が上位三つにあがり,鍵となる転写因子との複合体形成にSer265のリン酸化が関与していることが見いだされた8, 12).
5. 褐色脂肪細胞におけるβARシグナリングによるクロマチンルーピング
1)3次元(3D)クロマチン構造
3次元(3D)クロマチン構造は,ヒストンの翻訳後修飾に加えて組織特異的遺伝子発現の調節に重要な役割を果たす.エンハンサーは,しばしば標的遺伝子から数百~数千塩基離れた場所に位置するシス調節エレメントであり,遺伝子転写を増強するためにクロマチンループを介してプロモーターと相互作用し,組織特異的な転写制御をする13).たとえば,FTO(脂肪量および肥満関連タンパク質)のイントロン内のエンハンサーは,数メガ塩基離れて位置する調節エレメントがルーピング(ループ構造形成)によってプロモーターに近接する相互作用を介して,ホメオボックス転写因子(IRX3およびIRX4)の発現を調節し,これがベージュ脂肪細胞分化の抑制に関与する14, 15).前脂褐色肪細胞からの成熟分化の間,褐色脂肪細胞のマスターレギュレーター核内タンパク質PRDM1610, 16)はUcp1およびPgc1α遺伝子座に結合し,メディエーターMED1を動員してクロマチンループを介してプロモーター–エンハンサー相互作用を促進する17).このように分化に伴う特異的遺伝子発現に3Dクロマチン構造の変化が関与する.SWI/SNFクロマチン再構成因子は,この長距離のクロマチンルーピング構造をダイナミックに制御する.
一方,最近の研究から,3Dクロマチン立体構造が,細胞分化よりも短期間の生物学的な応答においても関与することが示されている.一つめの例として,転写因子Rev-erbαは24時間の明暗サイクルの間,クロマチンループを周期的に調節し,NCoR-HDAC3抑制複合体を動員し,クロマチンルーピングを媒介するメディエータータンパク質MED1を取り除くことによって肝臓における概日リズムを持たせた遺伝子転写を調節する18).二つめの例として,空腹時に糖質コルチコイドホルモンは,肝臓のヒストンメチル化酵素SETDB2のmRNA発現を誘導する.誘導されたSETDB2は,3Dクロマチン構造の変化を促進し,糖新生を促進する.この一連の糖質コルチコイド刺激から糖新生促進までの応答は2時間以内に起こる19).三つめの例として,さらに迅速な例は我々の見いだしたJMJD1Aである.寒冷ストレスの下流のβAR活性化に際して褐色脂肪細胞において10数分から始まるクロマチンループを介して熱産生遺伝子のプロモーター–エンハンサー相互作用を促進する(下記)8).
2)Ser265は寒冷センサーとして機能する足場タンパク質
我々は,JMJD1AがSWI/SNFクロマチン再構成因子と複合体を形成することから,褐色脂肪細胞ならびに組織において染色体コンホメーションキャプチャー(chromosome conformation capture:3C)解析を行った.βARシグナル伝達が活性化し,ヒストン脱メチル化酵素JMJD1Aがリン酸化されると,リン酸化されたJMJD1Aは,SWI/SNFクロマチン再構成因子と複合体を形成し,熱産生遺伝子(Ucp1およびAdrb1)上のPPAR応答エレメント(PPRE)に複合体中のPPARγを介して結合する.クロマチンループを介してのAdrb1遺伝子上のプロモーター–エンハンサーの近接は,JMJD1Aリン酸化レベルのタイミングとよく一致して,βAR刺激後15分以内に起こり,60分後にピークに達する.このタイミングでRNAポリメラーゼがリクルートされ,Adrb1 mRNA発現のレベルと相関する.重要なことに,この急性誘導はヒストン脱メチル化活性を必要としない8, 16).褐色脂肪細胞ではもとよりこのエンハンサー領域はH3K27ac修飾でユークロマチン状態にあり,抑制修飾H3K9me2はほとんどない12).
このようにして,ヒストン脱メチル化酵素JMJD1Aが脱メチル化活性とは独立に,自身のリン酸化とこれによって誘導されるSWI/SNFクロマチン再構成因子を介した急性のクロマチンルーピングを制御し,急速な転写誘導を行うという新しい概念を示した8, 16).
3)Jmjd1aのS265がリン酸化されない変異マウス
動物個体レベルで検証するために,我々は,Jmjd1aのS265がリン酸化されないようにSer265をアラニンに変えた変異をノックインしたマウス(Jmjd1a-S265AKI/KI)を作製した.このマウスは,寒冷刺激に対してはJMJD1A-KOのフェノコピーで,Ucp1やPgc1α, DIO2などの発現上昇が顕著に減弱し,寒冷曝露中に体温を維持できず,Ser265が寒冷センサーであることを示した12).
6. 皮下白色脂肪組織(scWAT)と慢性寒冷への適応機構(ベージュ化)
褐色脂肪細胞は,骨格筋細胞と同じMyf5遺伝子を発現する皮筋板に由来する前駆細胞から分化する.分化していく過程で骨格筋の鍵となる遺伝子に,H3K9me2の抑制メチル修飾が入ることによってそれらが転写抑制され,脂肪細胞へと変換される.そして,そのメチル化酵素はEHMT1[G9a-like protein(GLP)としても知られる]で,骨格筋細胞と褐色脂肪細胞との分化スイッチとして働く20).
一方,長い間寒冷環境に個体がさらされると,褐色脂肪細胞に特徴的な脂肪燃焼や熱産生に必要なUcp1などの熱産生遺伝子がscWATで発現してくる.このリモデリングプロセスは,「ベージュ化(肌色化)」と呼ばれ,慢性的な寒冷環境下に適応する仕組みである21).さて,scWAT中のベージュ細胞の誘導にエピゲノムはどう関与するのだろうか? マウスを4°Cで少なくとも1週間飼育すると,褐色脂肪細胞のように小さな脂肪滴を多数含んだ多胞構造をとるUCP1陽性の脂肪細胞,すなわちベージュ脂肪細胞がscWATに誘導されてくる.常温で飼育されたマウスのscWATの熱産生遺伝子は,抑制ヒストン修飾(H3K9me2)を受け転写抑制状態にあるが,4°C, 1週間の寒冷刺激後は,Ucp1のエンハンサーにおけるH3K9me2のレベルは顕著に減少し,これと呼応してUcp1の遺伝子発現,タンパク質の発現が上昇する12).これがベージュ化である.それでは,βアドレナリン受容体刺激によってどのようにして,scWATのH3K9me2メチル化が消去されるのか? 我々はH3K9me2の脱メチル化酵素JMJD1Aの酵素活性はこのベージュ化でこそ発揮するのではないかとの仮説を立てた.
寒冷センサーJMJD1AのSer265をアラニンに変異させたJMJD1Aノックインマウス(Jmjd1a-S265AKI/KI)を解析したところ,コントロールの野生型マウスと比べ,ベージュ化は著しく減弱していた.脂肪組織の形状もscWATのままで,UCP1をはじめとした熱産生遺伝子の発現も低値にとどまった12).同様の表現型はJMJD1A-KOマウスでも示された.このことから,寒冷センサーとして機能するJMJD1Aのリン酸化の必要性が示された.
scWATから樹立した不死化前駆脂肪細胞(im-scWAT)は,PPARγアゴニスト(チアゾリジン誘導体)などでベージュ化を誘導させることができる.一方,βブロッカーの存在下では著しくベージュ脂肪細胞特異的遺伝子発現が抑制されることから,培地中のウシ胎仔血清中のカテコールアミンによるβAR刺激とPPARγアゴニストによる活性化の二つのシグナルが両方必要であることがわかる12).このim-scWAT分化系においても,8日間の分化に伴いUcp1などの熱産生遺伝子は顕著に上昇し,これと呼応するようにエンハンサー領域のH3K9me2は減少した.
しかし,S265Aを発現した不死化前駆脂肪細胞ではこれらの遺伝子の発現は顕著に抑制された.また興味深いことにリン酸化を疑似させたS265D(アスパラギン酸)の変異JMJD1Aはこれら遺伝子の発現を上昇させた.褐色脂肪細胞の活性化にはJMJD1Aの脱メチル化能は必要なかった.それでは,ベージュ細胞の分化過程で熱産生遺伝子の発現にJMJD1Aの脱メチル化活性は必要なのか? 活性中心である1120番目のヒスチジン(H)をチロシン(Y)に変異させ酵素活性をなくしたJMJD1A-H1120Yを発現させると熱産生遺伝子の発現上昇は顕著に抑制され,脱メチル化の必要性が示された.
以上より,ベージュ細胞の熱産生遺伝子発現には,①抑制ヒストン修飾H3K9me2の脱メチル化が必要である,②これには,β-AR刺激によるJMJD1A265番目のセリンのリン酸化(第一段階),そしてヒストン脱メチル化(第二段階)が必要であることが示された.第一段階は寒冷(βAR)刺激の感知と必要なタンパク質複合体形成,第二段階は,メチル化状態の変化である(図3右).
本稿では,一つのエピゲノム酵素が,急性および慢性の寒冷環境下で二つの異なる熱産生組織で(褐色脂肪組織とベージュ化白色脂肪組織),二つの異なる分子メカニズムを介して環境への適応に寄与することを中心に概説した.
本稿で紹介しなかったが,もう一つの抑制メチル化ヒストン修飾H3K27me3の熱産生遺伝子からの脱メチル化は,ベージュ脂肪細胞特異的な遺伝子誘導のうえでもう一つの重要なステップで,H3K27脱メチル化酵素であるJMJD3もまた,ベージュ化に関与していると報告されている22).寒冷刺激下流のβARシグナル伝達活性化がJMJD3を直接調節してH3K27の脱メチル化をもたらすかどうかは明らかでない.また,寒冷刺激を受け,ベージュ脂肪細胞の特異的遺伝子発現にH3K27me3およびH3K9me2の脱メチル化がどのようにコーディネートされてクロマチン構造を正確に変化させていくのか,JMJD3の翻訳後修飾とJMJD1Aとの関係も不明で,今後の研究課題である.
また,ベージュ脂肪細胞はどれだけ続くのか,温かい環境下にもどると白色脂肪細胞になるのか? これに関しても興味深いエピゲノム機構が報告されている.マウスを1週間寒冷曝露するとscWAT中にベージュ脂肪細胞が誘導されてくるが,「再加温」(すなわち,寒冷からサーモニュートラルと定義される適応型熱産生を必要としない暖かい環境)によって,「白化」と呼ばれる形態変化とともにベージュ脂肪細胞における熱産生遺伝子の発現の減少を伴う.ベージュ脂肪細胞では,熱発生遺伝子のエンハンサーは,H3K4me1およびH3K27acの両方を有する「活性エンハンサー」である.しかし,白化したベージュ脂肪細胞では,熱産生遺伝子のエンハンサーはH3K27acを失うがH3K4me1を保持しており,これらの活性エンハンサーは準備状態のエンハンサーに戻る.この所見は,H3K27acが周囲温度の変化に応答して可逆的であり,熱産生遺伝子発現を調節することを意味する.興味深いことに,H3K4me1は逆転しなかった.この文脈において,H3K4me1はエピゲノム記憶の例として機能する.この記憶は,1回の長期間の低温ストレスを経験したマウスが,2回目の寒冷刺激に対して高度に適応性があるため,明らかな利点を提供するようである.寒さへの2回目の曝露の間に,体温を維持するためにscWAT内の熱発生遺伝子をより迅速かつ強固に発現する23).この細胞記憶は,動物が将来の寒冷刺激に備えるための,組織化された適応システムである.他のヒストン修飾(たとえば,H3K9me2およびH3K27me3)はもとより検出されておらず,scWATの再加温時に変化するかどうかは今後の研究が待たれる.
謝辞Acknowledgments
この論文を執筆するにあたり,当初からJMJD1A遺伝子欠損マウスのご提供をはじめご支援下さった眞貝洋一博士,立花誠博士,そして,褐色脂肪細胞をご提供くださった梶村慎吾博士,東京大学先端科学技術研究センター酒井研究室で本研究を推進してくださった稲垣毅博士,松村欣宏博士,阿部洋平博士をはじめ大学院生,スタッフの皆さま,そして,最後に同センターで質量分析や次世代シーケンサー解析をご支援下さった川村猛博士,油谷浩幸博士,児玉龍彦博士に感謝申し上げます.
引用文献References
1) Porter, C., Chondronikola, M., & Sidossis, L.S. (2015) The Therapeutic Potential of Brown Adipocytes in Humans. Front. Endocrinol. (Lausanne), 6, 156.
2) Michael, L.F., Asahara, H., Shulman, A.I., Kraus, W.L., & Montminy, M. (2000) The phosphorylation status of a cyclic AMP-responsive activator is modulated via a chromatin-dependent mechanism. Mol. Cell. Biol., 20, 1596–1603.
3) Altarejos, J.Y. & Montminy, M. (2011) CREB and the CRTC co-activators:sensors for hormonal and metabolic signals. Nat. Rev. Mol. Cell Biol., 12, 141–151.
4) Cao, W., Daniel, K.W., Robidoux, J., Puigserver, P., Medvedev, A.V., Bai, X., Floering, L.M., Spiegelman, B.M., & Collins, S. (2004) p38 mitogen-activated protein kinase is the central regulator of cyclic AMP-dependent transcription of the brown fat uncoupling protein 1 gene. Mol. Cell. Biol., 24, 3057–3067.
5) Robidoux, J., Cao, W., Quan, H., Daniel, K.W., Moukdar, F., Bai, X., Floering, L.M., & Collins, S. (2005) Selective activation of mitogen-activated protein (MAP) kinase kinase 3 and p38alpha MAP kinase is essential for cyclic AMP-dependent UCP1 expression in adipocytes. Mol. Cell. Biol., 25, 5466–5479.
6) Puigserver, P., Wu, Z., Park, C.W., Graves, R., Wright, M., & Spiegelman, B.M. (1998) A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis. Cell, 92, 829–839.
7) Uldry, M., Yang, W., St-Pierre, J., Lin, J., Seale, P., & Spiegelman, B.M. (2006) Complementary action of the PGC-1 coactivators in mitochondrial biogenesis and brown fat differentiation. Cell Metab., 3, 333–341.
8) Abe, Y., Rozqie, R., Matsumura, Y., Kawamura, T., Nakaki, R., Tsurutani, Y., Tanimura-Inagaki, K., Shiono, A., Magoori, K., Nakamura, K., et al. (2015) JMJD1A is a signal-sensing scaffold that regulates acute chromatin dynamics via SWI/SNF association for thermogenesis. Nat. Commun., 6, 7052.
9) Harms, M. & Seale, P. (2013) Brown and beige fat:development, function and therapeutic potential. Nat. Med., 19, 1252–1263.
10) Kajimura, S., Spiegelman, B.M., & Seale, P. (2015) Brown and Beige Fat: Physiological Roles beyond Heat Generation. Cell Metab., 22, 546–559.
11) Inagaki, T., Tachibana, M., Magoori, K., Kudo, H., Tanaka, T., Okamura, M., Naito, M., Kodama, T., Shinkai, Y., & Sakai, J. (2009) Obesity and metabolic syndrome in histone demethylase JHDM2a-deficient mice. Genes Cells, 14, 991–1001.
12) Abe, Y., Fujiwara, Y., Takahashi, H., Matsumura, Y., Sawada, T., Jiang, S., Nakaki, R., Uchida, A., Nagao, N., Naito, M., et al. (2018) Histone demethylase JMJD1A coordinates acute and chronic adaptation to cold stress via thermogenic phospho-switch. Nat. Commun., 9, 1566.
13) Heinz, S., Romanoski, C.E., Benner, C., & Glass, C.K. (2015) The selection and function of cell type-specific enhancers. Nat. Rev. Mol. Cell Biol., 16, 144–154.
14) Smemo, S., Tena, J.J., Kim, K.H., Gamazon, E.R., Sakabe, N.J., Gomez-Marin, C., Aneas, I., Credidio, F.L., Sobreira, D.R., Wasserman, N.F., et al. (2014) Obesity-associated variants within FTO form long-range functional connections with IRX3. Nature, 507, 371–375.
15) Herman, M.A. & Rosen, E.D. (2015) Making Biological Sense of GWAS Data:Lessons from the FTO Locus. Cell Metab., 22, 538–539.
16) Inagaki, T., Sakai, J., & Kajimura, S. (2016) Transcriptional and epigenetic control of brown and beige adipose cell fate and function. Nat. Rev. Mol. Cell Biol., 17, 480–495.
17) Harms, M.J., Lim, H.W., Ho, Y., Shapira, S.N., Ishibashi, J., Rajakumari, S., Steger, D.J., Lazar, M.A., Won, K.J., & Seale, P. (2015) PRDM16 binds MED1 and controls chromatin architecture to determine a brown fat transcriptional program. Genes Dev., 29, 298–307.
18) Kim, Y.H., Marhon, S.A., Zhang, Y., Steger, D.J., Won, K.J., & Lazar, M.A. (2018) Rev-erbalpha dynamically modulates chromatin looping to control circadian gene transcription. Science, 359, 1274–1277.
19) Roqueta-Rivera, M., Esquejo, R.M., Phelan, P.E., Sandor, K., Daniel, B., Foufelle, F., Ding, J., Li, X., Khorasanizadeh, S., & Osborne, T.F. (2016) SETDB2 Links Glucocorticoid to Lipid Metabolism through Insig2a Regulation. Cell Metab., 24, 474–484.
20) Ohno, H., Shinoda, K., Ohyama, K., Sharp, L.Z., & Kajimura, S. (2013) EHMT1 controls brown adipose cell fate and thermogenesis through the PRDM16 complex. Nature, 504, 163–167.
21) Wang, W. & Seale, P. (2016) Control of brown and beige fat development. Nat. Rev. Mol. Cell Biol., 17, 691–702.
22) Pan, D., Huang, L., Zhu, L.J., Zou, T., Ou, J., Zhou, W., & Wang, Y.X. (2015) Jmjd3-Mediated H3K27me3 Dynamics Orchestrate Brown Fat Development and Regulate White Fat Plasticity. Dev. Cell, 35, 568–583.
23) Roh, H.C., Tsai, L.T.Y., Shao, M., Tenen, D., Shen, Y., Kumari, M., Lyubetskaya, A., Jacobs, C., Dawes, B., Gupta, R.K., et al. (2018) Warming Induces Significant Reprogramming of Beige, but Not Brown, Adipocyte Cellular Identity. Cell Metab., 27, 1121–1137.
著者紹介Author Profile
 酒井 寿郎(さかい じゅろう)
酒井 寿郎(さかい じゅろう)東北大学大学院医学系研究科細胞生物学講座分子生理学分野教授,東京大学先端科学技術研究センター代謝医学分野教授(クロスアポイントメント制度により東大/東北大併任).博士(医学).
略歴1988年東北大学医学部卒業,94年同大学院修了(医学博士),同年テキサス大学サウスウェスタンメディカルセンター(Goldstein & Brown博士)博士研究員.帰国後,2000年東北大学病院腎高血圧内分泌助手,ERATOグループリーダーを経て,03年より東京大学特任教授.09年より東京大学教授,17年より東北大学教授.クロスアポイントメントにより引き続き東京大学教授併任.
研究テーマと抱負環境からの刺激に対するエピゲノムを介した応答適応機構の解明を土台とした生活習慣病と加齢に伴う変化の病因解明
ウェブサイトhttp://www.mm.rcast.u-tokyo.ac.jp/(東京大学先端科学技術研究センター)
http://www.metab.med.tohoku.ac.jp/(東北大学大学院医学系研究科分子生理学分野)
趣味音楽鑑賞,写真撮影.