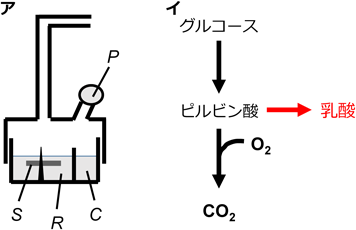
ワールブルグ効果(Warburg effect)は,がん代謝の分野において,これまで最も注目を集めてきた腫瘍形質だろう.ほぼ1世紀前,O. Warburgらは,当時提唱されていたパスツール効果が腫瘍組織においてはみられないことを観察した(図1).すなわち,正常組織とは異なり,腫瘍組織においては,“酸素分圧を上げてもグルコース依存性の乳酸産生が下がらない”ことを発見した.腫瘍組織では,酸素濃度が十分に高い条件でも,TCA回路の回転(CO2の生成)と比較した際,乳酸産生量が高い傾向がある,ということもできる.本稿ではひとまず,ワールブルグ効果とはそのような内容と定義して話をすすめる.
彼らの観察とそれにまつわる考察が,その後のがん代謝研究の進展に与えた影響はきわめて大きい.しかし,同時に,主に技術的な制約から,実験の条件設定や解釈において問題がなかったわけではない.そのため,少し考えてみると,現代のがん代謝モデルにそのまま当てはめるのが容易ではないことに気づく.たとえば,Warburgらは組織スライスの代謝活性をモニターしたわけだが,その際,組織が浸されたリンゲル液には,グルコース以外の炭素源が含まれていない.腫瘍はグルコース以外にも多くの栄養素を炭素源として利用していることを,現代の我々は知っている.グルタミンやアミノ酸,より最近では,これまで主に単なる排泄物と考えられていた乳酸までもが,がんにとって重要な炭素源となっていることが明らかになっている1, 2).当然のことながら,彼らの計算において,一度排出された乳酸が再利用されるなどという可能性は考慮されていない.また,冒頭において,グルコース“依存性”の乳酸産生とわざわざ記したのは,その乳酸が本当にグルコースに由来しているという確証がないからだ.筆者の経験上も,培地中にグルコースを添加すると,乳酸産生が,一気に,そして劇的に高まるのは確かである.しかし,その際,新たな乳酸生成にグルコース由来の炭素ばかりが使われているかというと,答えは否だ.
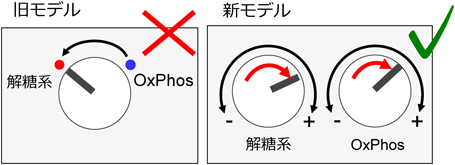
このように,彼らの結果・解釈にはさまざまな問題が内包されているが,中でも,好気呼吸について,見過ごせない大きな誤解・齟齬がある.Warburgらは,冒頭に述べたような観察結果を,“腫瘍細胞ではグルコースの酸化(TCA回路)が、正常組織と比べて抑制されているため”と解釈した.そしてその原因を,好気呼吸の場であるミトコンドリアの異常に求めた.ほとんどのがんで腫瘍細胞の好気呼吸システム自体に異常がないことは広く知れわたってきている.しかし,問題はそこではない.新たな技術(安定同位体トレーサー解析や細胞外フラックス解析装置など)の普及に伴い,“腫瘍の好気呼吸レベルは、対応する正常組織と比べて低い”という推論がそもそも正確ではないことが近年明確になってきている3, 4).少なくとも米国での動向をみると,その部分の誤解はずいぶん解消されたと感じる.以前よく見かけた“がん代謝”のモデルでは,エネルギー代謝が,正常組織での好気呼吸から,がんでの解糖系へと「スイッチ」する(旧モデル,図2).これに対し,最近の理解は,「がんでは解糖系・好気呼吸の両方の活性が,正常組織・細胞と比べて上昇している」というモデルへと改められた(新モデル,図2).がんと正常組織を比べた場合,好気呼吸の活性化度合いは解糖系のそれより低いかもしれない.しかし,がんの好気呼吸が正常組織・細胞よりも低いというのは明らかに誤り,というのが趨勢である.ひるがえって本邦では,先日,京都で行われた生化学会大会に出席した際,複数の発表者の方々が,「がんではエネルギー代謝が好気呼吸から解糖系へと切り替わる」とか「正常と比べ,がんではミトコンドリア好気呼吸が抑制されている」と断言されていて,非常に暗い気分になった.
2. PKMとワールブルグ効果:メカニズムと問題点
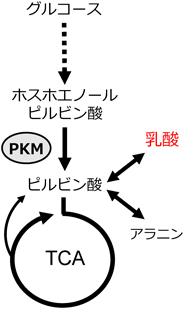
さて,あれこれ問題があるワールブルグ効果であるが,多くのがんが,そのような代謝形質(高い乳酸産生/好気呼吸比)を示すのは事実である.しかし,この形質のがんにおける役割はよくわかっていない.この点において,この10年ほど,強い関心を集めてきたのが解糖系酵素ピルビン酸キナーゼM(PKM)である.PKMは,解糖系における三つの不可逆反応のうちの一つ,ホスホエノールピルビン酸からピルビン酸への反応を触媒する.ピルビン酸は,TCA回路に動員される可能性と乳酸へと代謝される可能性の両方がある,代謝ネットワーク上でハブとなっている代謝物である(図3).
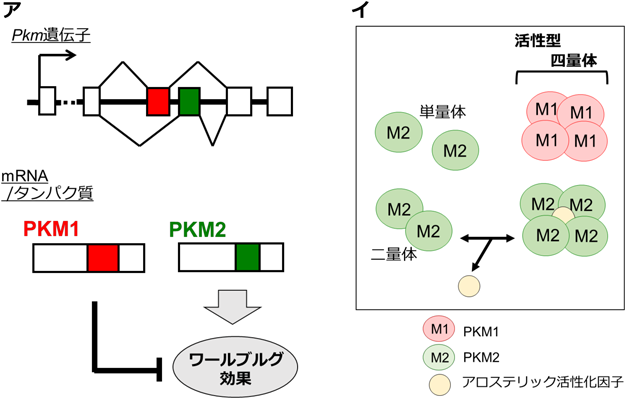
2008年,この酵素の性質とワールブルグ効果との密接な関連を指摘する,非常に重要な報告がなされた5).具体的には,PKMには選択的スプライシングで生じる二つのアイソフォーム(PKM1, PKM2)が存在するが,これらのうち,がんにおけるPKM2の選択的発現が,腫瘍細胞のワールブルグ効果に非常に大きく寄与していることが明らかにされた(図4).これまで知られるほぼすべてのがんは,PKM1ではなく,PKM2を主に発現しているのだが,それをPKM1で置き換えると,ワールブルグ効果がキャンセルされることが示された.
それでは,なぜ,ワールブルグ効果形成のためにはPKM1ではダメなのか? その原因は,両アイソフォームの活性制御の違いが重要とされている(図4).PKMは,四量体を形成することで初めてその酵素活性が現出する.PKM1は,特に他因子に依存することなく,発現すると自動的に四量体を形成する.つまり,PKM1は,構成的な高活性型である.一方,PKM2は,通常,単量体あるいは二量体として細胞内に存在する.PKM2が四量体を形成するには,アロステリック活性化因子(F1, 6BPやセリンなど)の存在が必須であり,そのため,それら因子の細胞内レベルが上昇したときのみ活性化する.つまり,PKM2は,条件的な活性化型である.そのようなアロステリック制御は,結果として,PKM1と比べた場合,細胞におけるピルビン酸の生成レベルを低く保つことになる.そのような作用を通じてPKM2がもたらす低い“グルコースからピルビン酸へのフラックス”が,そのまま下流であるTCA回路への炭素源流入を制限するモデルが提唱された6).この際,PKM2によってピルビン酸生成が低下する一方,なぜ同時に乳酸産生の亢進が起きるのか?という点は謎とされ,そのまま現在に至っている.
もう一点,以前,“正常細胞はPKM1型、がんはPKM2発現型”というモデルがあったが,少なくない研究から,これは誤りであることが明確になっている7–9).大半の上皮細胞を含め,がんの起源となるような細胞のほとんどは,いかなる発がんイベントもなしに,元来PKM2を発現している.正常細胞におけるPKMのアイソフォーム選択は,主に,細胞の分化系列によって規定されることが示唆されている9).一方で,ほぼすべての腫瘍細胞がPKM1よりもPKM2を圧倒的に発現していることは確かであり,この事実は,多くの腫瘍がワールブルグ効果を示すことと一致している.それでは,PKM2(および,それがもたらすワールブルグ効果)は,がんを促進する作用があるのか?
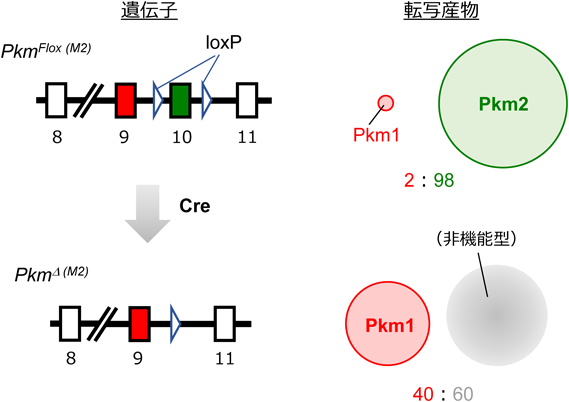
当初,いくつかの細胞株を用いた実験成績は,上記アイディアを支持するものだった5).ところが,PKM2特異的なノックアウト(KO)マウスが作製され,その表現型が明らかになるにつれ,事態は一気に混沌化することになる.Vander Heidenらの手によるPKM2-KOマウスは,PKM遺伝子にて,PKM2特異的なエキソンのみを欠失させた遺伝子改変マウスである.驚いたことに,そのようなPKM2欠損マウスにおいて,がんが促進されることがわかった8, 10, 11).PKM2は,がん促進的どころか,がん抑制的である可能性すら出てきたのである.しかしながら,PKM2-KOマウスは,その問題を扱うには不向きな,あるシステム上の問題を抱えていた.具体的には,PKM2欠損に伴って,代償的に,PKM1が中途半端な程度に発現するという問題である(図5).そのため,PKM2-KOは細胞のPKM活性を低下させているのか,それとも上昇させているのか判然としないことになってしまった.また,Cre-loxPシステムと併用した場合には,その組換え効率が100%ではないことも,よりいっそう,結果の解釈を困難にした.
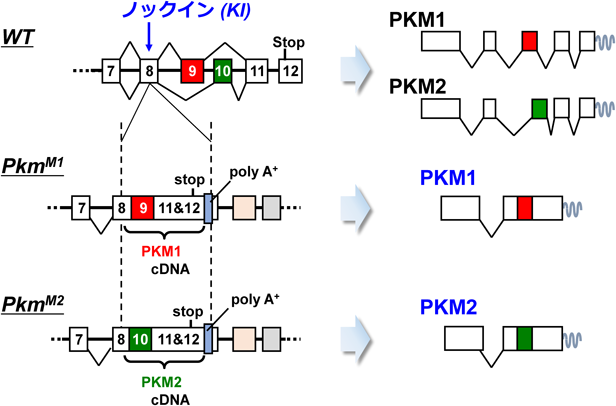
筆者らのグループは,前節の問題を解決し,PKM1およびPKM2のアイソフォーム特異的な機能を明確にするため,新たなPKM遺伝子改変マウスであるPKMノックインマウスを開発した12).これら変異マウスでは,内在性PKM遺伝子座に,PKM1あるいはPKM2をコードするcDNAがノックイン(KI)挿入してある(図6).そのため,これら変異アリルからは,PKM1(PkmM1から)あるいはPKM2(PkmM2から)の,いずれか片方のアイソフォームしか発現しない.重要なのは,それら変異アリルに由来する各アイソフォームの発現は,基本的にそろっているという点である.
上記変異マウスの発がんポテンシャルを調べるため,Pkm-KIに加えKrasLSL-G12D変異を併せ持つPkm;KrasダブルKIマウスを作製した.これらマウスにCre発現アデノウイルスを気管内投与し,肺がんを誘導した.驚いたことに,Pkm1-KIマウスでは,Pkm2-KIや野生型マウスと比べ,肺がん形成が促進されていた.Pkm-KIの効果をより広範に調べるため,新生仔マウスに発がんイニシエーターであるDMBAを塗布し,経過を観察した.通常,野生型マウスにDMBAを単独で塗布しても,腫瘍形成まで至ることはない.一般的には,DMBAに加えて何らかの発がんプロモーター(TPAやオカダ酸など)が追加的に必要とされる.ところが,Pkm1-KIマウスでは,肝がんを中心に,さまざまな腫瘍性病変をみとめた.野生型マウスやPkm2-KIマウスでは,そのような病変は一切みとめられなかった.これら結果は,Pkm1に発がんプロモーターとしての作用があることを強く示している.一連のマウス動物実験により,Pkm1が,Pkm2よりも,強いがん促進作用を持つことが示された12).
Pkm1によるがん促進作用が,腫瘍細胞自律的なものか否かを調べるため,Pkm-KIマウスからマウス胎仔線維芽細胞(MEF)および肺上皮(LE)細胞を単離して不死化したのち,発がん変異型KrasやEGFRで形質転換し,解析を行った12).培養系においては,形質転換MEFおよびLE細胞の増殖に,Pkmの遺伝子型による差異はみとめられなかった.ところが,これら細胞をヌードマウスに移植し,その腫瘍増大を比較したところ,Pkm1-KI腫瘍では,Pkm2-KIおよび野生型腫瘍に比べ,腫瘍増大が早かった.これら実験により,Pkm1が,腫瘍細胞自律的に,腫瘍増殖を促進できることが示された.
4. PKM1によるグルコース代謝亢進とワールブルグ効果解消
PKM1による腫瘍促進の分子機構を探るため,Pkm1およびPkm2-KI細胞の代謝を比較することにした.13C標識グルコースを用いたトレーサー実験を行ったところ,PKM1が,グルコース由来炭素のTCA回路への流入および乳酸への変換,そのいずれもを促進させることがわかった.重要なことに,Luntらが提唱したモデルとは異なり13),PKM1によって核酸や各種アミノ酸の生合成が妨げられることはなかった12).
このとき,もう一つ,興味深い観察結果が得られた.それは,PKM1はPKM2と比べ,グルコースからの乳酸産生を上昇させる一方,総乳酸産生を減少させるというものであった.この結果は,Christofkらの報告にきわめて類似しており5),あらためて,PKM2がワールブルグ効果様の性質に寄与していることを再確認することができた.同時に,PKM2発現細胞でみられる乳酸産生の増加は,グルコース以外の炭素源に由来している可能性を示していた.
そこで,13C標識グルタミンを用いたトレーサー実験を行った結果,Pkm2-KI細胞では,Pkm1-KIと比べ,グルタミンが,より活発に,アスパラギン酸やピルビン酸・アラニン・乳酸へと代謝されていることがわかった.これら結果と一致して,PKM2が,グルタミン消費を亢進させる結果も得られた.
一連の代謝解析によって,PKM1が,各種生体成分の生合成を妨げることなくグルコースの異化を亢進すること,一方で,栄養源としてのグルタミン利用を減弱させることが明らかになった.そのような代謝ネットワークのリプログラミングが,未解明の制御メカニズムを通じて,結果的に総乳酸産生を低下させていると思われる12).
我々がPkm-KIモデルを使って得た一連の検討結果は,もし腫瘍細胞に発現すれば,PKM1の方が,PKM2よりも,強いがん促進作用を持つことを示していた.しかし,これまでのところ,PKM1を発現するヒトがんは知られていなかった.我々はこれを,ほとんどのがん起源が元来PKM2発現型だからではないか?と考え,PKM1を発現する正常細胞に着目した12).そのうちの一つが,気管支の神経内分泌細胞である.重要なことに,この細胞は,肺がんのなかでも高悪性で知られる小細胞肺がん(small-cell lung cancer:SCLC)の起源と考えられている.SCLCは,全肺がんの15~20%を占めている.他のタイプのがんと比べ,初回の抗がん剤治療・放射線治療が効きやすい傾向にあるが,その大半が再発を来し,予後はむしろ悪い.大半の症例でTP53とRB1遺伝子の同時機能喪失がみとめられているが,これまでに創薬可能なドライバー遺伝子異常は発見されていない14).
手術検体および細胞株を用いた検討などにより,SCLCでは,PKM1発現が高く,PKM1/PKM2比も,他がん種と比べて圧倒的に高いことがわかった12).質量分析にもとづいた絶対定量により,タンパク質レベルでのPKM1/PKM2比を肺がん細胞株間で比較したところ,SCLCでの値は,非SCLCのそれと比べて10~20倍程度も高いことがわかった.
SCLCにおけるPKM1発現の意義を調べるため,ヒトSCLC細胞株を親株として,PKM1あるいはPKM2のどちから一方のみ発現する細胞株を作製し,増殖を調べた.その結果,PKM2のみを発現する細胞では,PKM1のみを発現する細胞と比べ,増殖が著しく減弱されていた.つまり,PKM2では,PKM1の役割を相補できないことがわかった.これら結果から,少なくとも検討したSCLC株においては,PKM1に起因する高いPKM活性が,増殖・生存に必須であることが示唆された.
Pkm-KIマウスを使った今回の検討により,PKM1は,PKM2よりも,1)各種生合成経路を減弱させることなく,グルコース代謝を亢進させ,2)腫瘍増殖を促進させることができることがわかった.これら結果は,既存の“PKM2によるグルコース異化の制限が、がんに必須である”という定説を覆すもので,ワールブルグ効果の役割についての再考が必要となるだろう.我々の結果からは,ワールブルグ効果は,腫瘍細胞自律的には,がん細胞の増殖にむしろ不利に働くことを示唆している.よって,もしワールブルグ効果に腫瘍促進的な側面があるとすれば,それは非細胞自律的なものではないかと考えている.がん代謝と微小環境との相互作用などについて,今後,さらなる解析が必要と考えている.
これらの問題とは別に,SCLCがPKM活性の低下という代謝干渉に対して脆弱であるという点は,大へん興味深いと思っている.SCLCの治療をめぐっては,この15~20年の間,根本的な進歩はほとんどなかった.この難治性肺がんの場合,現時点で創薬可能なゲノム変異がほとんど存在しないことも明らかになっており,非ゲノム性の創薬アプローチの重要性が指摘されていた.今回,PKM1やその関連形質が,SCLCの新たな治療標的となる可能性が示された.現在,それらを標的とする新規治療の開発に取り組んでいる15).
謝辞Acknowledgments
多くの共同研究者の皆さまにお礼申し上げます.
引用文献References
1) Faubert, B., Li, K.Y., Cai, L., Hensley, C.T., Kim, J., Zacharias, L.G., Yang, C., Do, Q.N., Doucette, S., Burguete, D., et al. (2017) Lactate Metabolism in Human Lung Tumors. Cell, 171, 358–371.
2) Hui, S., Ghergurovich, J.M., Morscher, R.J., Jang, C., Teng, X., Lu, W., Esparza, L.A., Reya, T., Le, Z., Yanxiang Guo, J., et al. (2017) Glucose feeds the TCA cycle via circulating lactate. Nature, 551, 115–118.
3) DeBerardinis, R.J. & Chandel, N.S. (2016) Fundamentals of cancer metabolism. Sci. Adv., 2, e1600200.
4) Koppenol, W.H., Bounds, P.L., & Dang, C.V. (2011) Otto Warburg’s contributions to current concepts of cancer metabolism. Nat. Rev. Cancer, 11, 325–337.
5) Christofk, H.R., Vander Heiden, M.G., Harris, M.H., Ramanathan, A., Gerszten, R.E., Wei, R., Fleming, M.D., Schreiber, S.L., & Cantley, L.C. (2008) The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature, 452, 230–233.
6) Vander Heiden, M.G., Cantley, L.C., & Thompson, C.B. (2009) Understanding the Warburg effect:the metabolic requirements of cell proliferation. Science, 324, 1029–1033.
7) Bluemlein, K., Grüning, N.M., Feichtinger, R.G., Lehrach, H., Kofler, B., & Ralser, M. (2011) No evidence for a shift in pyruvate kinase PKM1 to PKM2 expression during tumorigenesis. Oncotarget, 5, 393–400.
8) Dayton, T.L., Gocheva, V., Miller, K.M., Israelsen, W.J., Bhutkar, A., Clish, C.B., Davidson, S.M., Luengo, A., Bronson, R.T., Jacks, T., et al. (2016) Germline loss of PKM2 promotes metabolic distress and hepatocellular carcinoma. Genes Dev., 30, 1020–1033.
9) Sato, T., Morita, M., Nomura, M., & Tanuma, N. (2018) Revisiting glucose metabolism in cancer:lessons from a PKM knock-in model. Mol. Cell. Oncol., 5, e1472054.
10) Israelsen, W.J., Dayton, T.L., Davidson, S.M., Fiske, B.P., Hosios, A.M., Bellinger, G., Li, J., Yu, Y., Sasaki, M., Horner, J.W., et al. (2013) PKM2 isoform-specific deletion reveals a differential requirement for pyruvate kinase in tumor cells. Cell, 155, 397–340.
11) Tech, K., Tikunov, A.P., Farooq, H., Morrissy, A.S., Meidinger, J., Fish, T., Green, S.C., Liu, H., Li, Y., Mungall, A.J., et al. (2017) Pyruvate kinase inhibits proliferation during postnatal cerebellar neurogenesis and suppresses medulloblastoma formation. Cancer Res., 77, 3217–3230.
12) Morita, M., Sato, T., Nomura, M., Sakamoto, Y., Inoue, Y., Tanaka, R., Ito, S., Kurosawa, K., Yamaguchi, K., Sugiura, Y., et al. (2018) PKM1 confers metabolic advantages and promotes cell-autonomous tumor cell growth. Cancer Cell, 33, 355–367.
13) Lunt, S.Y., Muralidhar, V., Hosios, A.M., Israelsen, W.J., Gui, D.Y., Newhouse, L., Ogrodzinski, M., Hecht, V., Xu, K., Acevedo, P.N., et al. (2015) Pyruvate kinase isoform expression alters nucleotide synthesis to impact cell proliferation. Mol. Cell, 57, 95–107.
14) George, J., Lim, J.S., Jang, S.J., Cun, Y., Ozretić, L., Kong, G., Leenders, F., Lu, X., Fernández-Cuesta, L., Bosco, G., et al. (2015) Comprehensive genomic profiles of small cell lung cancer. Nature, 524, 47–53.
15) Nomura, M., Morita, M., & Tanuma, N. (2018) A metabolic vulnerability of small-cell lung cancer. Oncotarget, 9, 32278–32279.
著者紹介Author Profile
 田沼 延公(たぬま のぶひろ)
田沼 延公(たぬま のぶひろ)宮城県立がんセンター研究所がん薬物療法研究部主任研究員.博士(理学).
略歴1974年埼玉県生まれ.96年北海道大学理学部化学第二学科卒業,北海道大学遺伝子病制御研究所助教を経て,2006年より現所属.
研究テーマと抱負がんと代謝等.ポスドク,大学院生,テクニシャン募集中です.ご連絡ください.
ウェブサイトhttp://www.miyagi-pho.jp/mcc/kenkyu/yakubutsu.html(宮城県立がんセンター研究所がん薬物療法研究部)
http://www.med.tohoku.ac.jp/about/laboratory/157.html(東北大学大学院医学系研究科がん分子制御学)