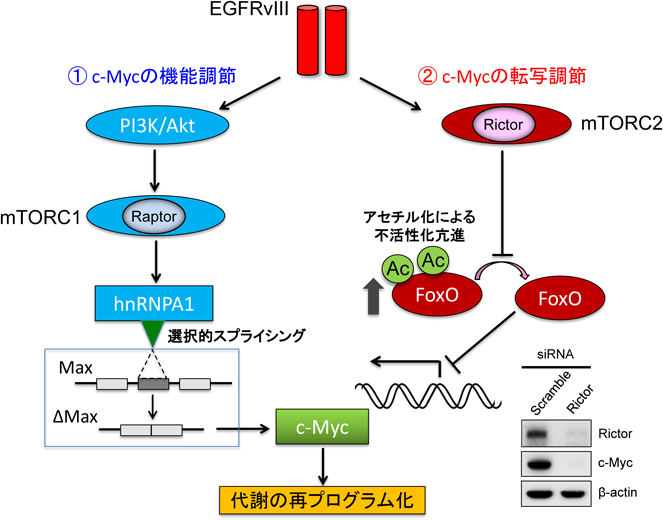
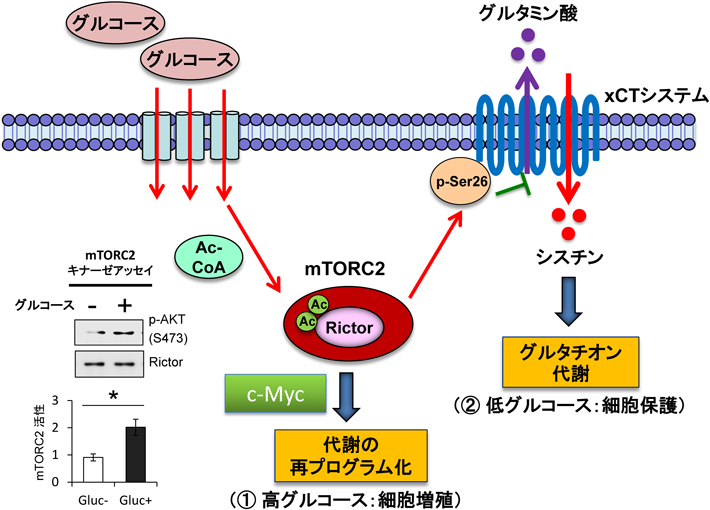
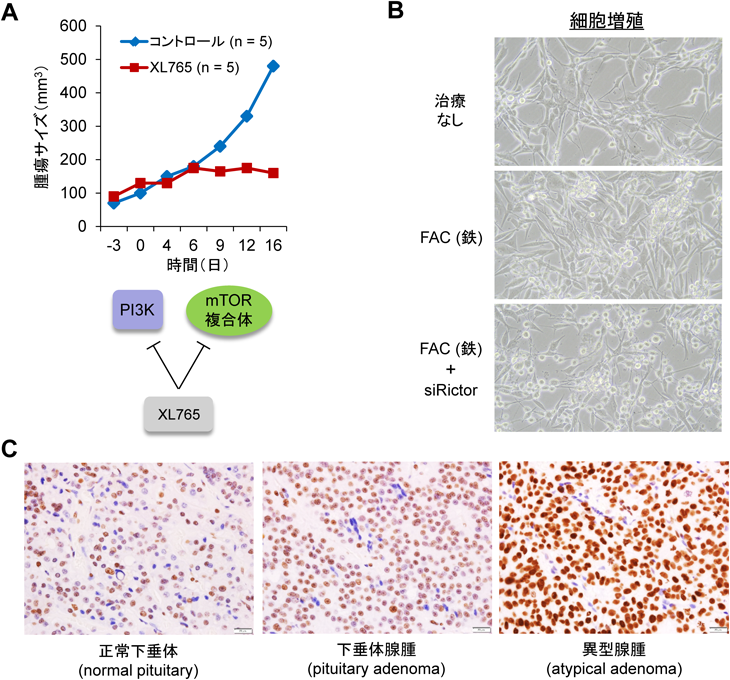
mTOR複合体によるがん細胞の代謝の変化とその意義The significance of metabolic and epigenetic regulation by mTOR complexes in cancer cells
東京女子医科大学医学部病理学(病態神経科学分野)Department of Pathology, Division of Pathological Neuroscience, Tokyo Women’s Medical University ◇ 〒162–8666 東京都新宿区河田町8–1 ◇ 8–1 Kawada-cho, Shinjuku, Tokyo 162–8666, Japan