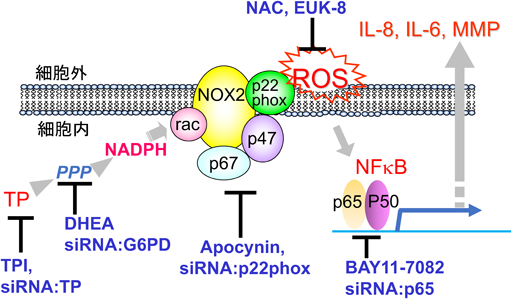
TP発現細胞で誘導されるサイトカイン,ケモカインやMMPなどの発現の上昇の原因を明らかにするため,我々はTPの発現がない類上皮がんKB細胞にTPを強制発現させた細胞でのみ発現が上昇している血管新生因子であるインターロイキン8(IL-8)に注目して解析した34).KB細胞に一過性にTPのcDNAを導入するとTPの発現に相関してIL-8発現が誘導されるが,酵素活性を欠失したTPの導入ではIL-8は誘導されなかった.IL-8遺伝子の5´非翻訳領域翻訳開始点からマイナス180塩基までの範囲に転写因子AP-1, NF-IL-6, NFκBの結合部位が存在する.これらの結合部位の点変異を持つプロモーターを用いてTP発現KB細胞でプロモーター活性を調べたところ,NFκBの結合部位の変異体では特に活性が大きく低下した.また,NFκBの阻害剤であるBAY11-7082の処理でIL-8のプロモーター活性が低下し,IL-8の発現も減少した.また,NFκBの結合部位のみをつないだレポーターアッセイを行い,TPの遺伝子導入あるいはTPのsiRNA導入に応じて活性が相関すること,酵素活性の欠失したTPでは活性が低いことを確認した.また,実際にTP発現細胞ではNFκBの下流の分子であるIL-11, IL-6, platelet-derived growth factor B(PDGFB),xanthine dehydrogenase, fibronectin(FN-1)などの発現が高まっていた34).胃がんのDNAアレイによる発現データベースを用いた解析からTPの発現とheme oxygenase-1(HO-1),IL-8, IL-6, FN-1などの発現に相関があった34).さらにN-アセチルシステイン(NAC)とEUK-8はp65の核内移行を低下させ,IL-8 mRNAの産生を抑制した.これらのことからTP発現細胞では活性酸素種(reactive oxygen species:ROS)の上昇がNFκBを活性化していることが予想された.実際,TP発現細胞では基質であるチミジンの添加によりTPの酵素活性依存的にROSが高まっており,チミジンの異化に依存してROSが増加している可能性が示された35).
ROSの由来としてNADPHオキシダーゼに注目して解析を行った.NADPHオキシダーゼはNOX1, NOX2, NOX3, NOX4, NOX4D, NOX5, DUOX1とDUOX2のサブユニットを持つ8種類の分子複合体が同定されている.実験に用いたKB細胞ではこのうちのNOX2の発現が飛び抜けて高かった.NOX2の阻害分子であるApocyninあるいはNOX1~4と複合体を形成するp22phoxに対するsiRNAを用いるとROSの蓄積が抑制され,同時にIL-8のmRNA産生量も低下した.内因的にTPを高発現しているYumoto細胞ではDuox1の遺伝子が主に発現しており,Duox1のsiRNAを作用させるとROSの抑制とIL-8の発現の低下を確認できた35).
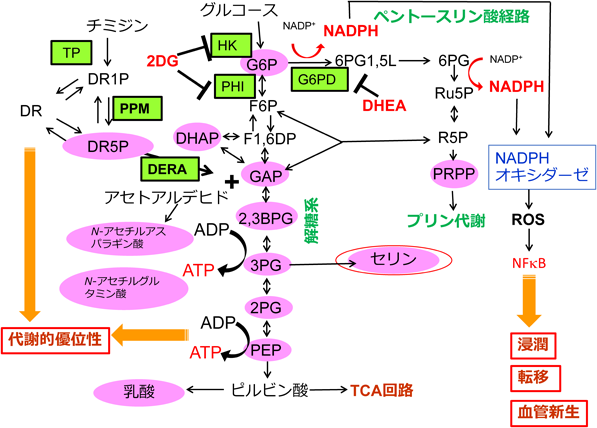
NADPHを測定すると,TP導入細胞ではチミジン濃度に依存してNADPHが上昇し,Yumoto細胞ではTPに対するsiRNAの処理で減少した.細胞質でのNADPHの主な生産系はPPPであることから,PPPの最初のそして律速の酵素であるグルコース-6-リン酸脱水素酵素(G6PD)に注目した.その阻害剤であるdehydroepiandrosterone(DHEA),あるいはG6PDに対するsiRNAにより処理することで,TP発現上昇によるNADPHの増加を抑えることが可能であった.このときROSの下流で発現が誘導されると考えられるHO-1のmRNAの発現も抑制された.TP発現細胞を無血清培地中でチミジンに継続的に曝露して1, 3, 24, 48時間後のTP発現細胞についてメタボローム解析を行った.曝露後1時間後をピークに2-デオキシ-d-リボース5-リン酸(DR5P)が観察され,3時間以降には低下した.一方,3時間をピークとしてリブロース5-リン酸,リボース5-リン酸,5-ホスホリボシルピロリン酸(PRPP)の増加が観察された35).上記のメタボローム解析の結果はチミジンからペントースリン経路への代謝経路が存在していることを示している.また,TP発現細胞ではチミジンの異化の増加によってNADPHの上昇とROSの発生を介して,NFκBの活性化とIL-8などのサイトカインやMMPの発現が血管新生・浸潤・転移の一因となっていることが明らかになった(図1).一方,NADPHの上昇はグルタチオン還元酵素の活性の上昇を介して還元型グルタチオンを増加させることが知られているが,TP発現細胞では還元型GSHも低下していた36).今のところTPが還元型GSHを低下させる直接の原因は明らかでない.
5. TP発現による解糖系,ペントースリン酸経路の活性化
上記のチミジン曝露によるメタボローム解析の結果は,チミジンが解糖系を介してPPPに入る経路の存在を示唆している.dDRが解糖系に入る可能性が以前に指摘されており37),dDRが誘導するHUVECのS6キナーゼのリン酸化,血管内皮の遊走性やラットの大動脈のチューブ形成をラパマイシンが阻害するなどの報告から38),TPあるいはdDRが細胞のエネルギー代謝に変化を与えることが予想された.
しかし,通常の培養条件ではTP発現の有無で増殖などに違いはなく,細胞におけるTP発現による代謝的な優位性は明らかではなかった.我々はKB細胞を無血清培地で継続的に培養して観察した.TP非発現KB細胞では2日目には増殖が停止しアポトーシスが観察されたが,TP発現細胞は4日まで増殖を続けることが可能であった.4日目には培地中のグルコースとグルタミンはほぼ枯渇していた.また,グルコースからグルコース6-リン酸(G6P)への代謝に働くヘキソキナーゼとG6Pからフルクトース6-リン酸への変換に働くホスホヘキソースイソメラーゼの働きを阻害して解糖系を阻害する2-デオキシグルコース(2DG)に対しても,TP発現細胞は2倍以上の抵抗性を示した.通常の培養条件では細胞の増殖に影響しない濃度のTPIが低栄養状態でのTP発現細胞の増殖優位性(4日目までの増殖)を抑制し,2DG抵抗性も低下させた39).
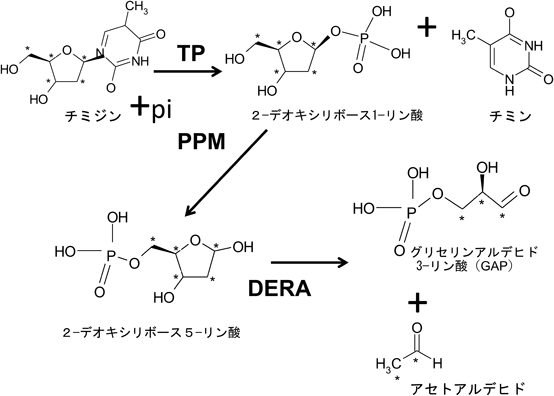
大腸菌やサルモネラ菌では,DR5PがDR5Pアルドラーゼ(DERA)の働きによって解糖系の中間代謝物であるグリセルアルデヒド3-リン酸(GAP)とアセトアルデヒドに変換されることが知られている(図2).哺乳細胞でもDERAの存在は知られていたが,実際にこの代謝経路が機能していることを示す報告はほとんどなかった.そこで,チミジンのすべての炭素を安定同位体標識した13C5チミジンを用いて,その異化経路についてメタボローム解析を行った.血清を含まない培地にチミジンを曝露し続けて1, 3, 48時間後に解析した結果,1時間後から標識されたDR5P,乳酸が検出され,3時間にはRPRRが検出された.この条件で比較的限られた代謝物しか検出できなかったので,条件を変更し血清入りの培地に培養後,チミジンを含む無血清培地に1時間曝露したところ解糖系代謝分子としてGAP,ジヒドロキシアセトンリン酸(DHAP),2,3-ビスホスホグリセリン酸(2,3BPG),3-ホスホグリセリン酸,2-ホスホグリセリン酸,ホスホエノールピルビン酸が確認できた.G6Pは曝露後10分の早期にのみ検出可能であった.内因性にTPを発現しているYumoto細胞や膵臓がんのPanc1細胞でもDR5Pと乳酸の蓄積を確認でき,これらの形成はTPのsiRNAで抑制できた.また,アセトアルデヒドの下流分子と考えられるN-アセチルアスパラギン酸とN-アセチルグルタミン酸も検出された(図3)39).これらの結果からTP発現の高まっている細胞ではチミジンの異化代謝から解糖系そしてPPPへの流入が確認できた.また,DERAをノックダウンすることでTP発現細胞の低栄養抵抗性が低下し,NADPHとIL-8の上昇も抑制されたことから,チミジンが異化から解糖系への流入とPPPの活性化を通して,TP発現細胞の低栄養抵抗性と腫瘍細胞の悪性化に寄与していることを明らかにできた39).
低栄養時のチミジンの代謝を検討するため,無血清培地で1日あるいは4日間(低栄養)培養後に細胞を13C5チミジンに曝露してメタボローム解析を行った.TP非発現細胞のチミジン量はいずれの条件でも高く保たれるが,TP発現細胞の場合,4日間の条件ではチミジンの蓄積が1日に比べて半分程度まで低下し,チミジンの異化が亢進していることと一致した.DR5Pと乳酸はTP発現細胞で1日,4日間両方の条件で検出された.TP発現細胞では4日の条件でのみ13Cセリンの量が顕著に増加していたが,非発現細胞では検出されなかった39).セリンは解糖系の代謝物3PGから3ステップで合成され,レドックス機構やプリン,チミジンの合成,ヒストンのメチル化にも関与しており,がん細胞への代謝的寄与が報告されている.これらの結果から,低栄養時にチミジンの異化代謝はエネルギー産生やセリン合成を補って機能している可能性が示された(図3).
一方,13C標識dDRを用いてdDRがTP非発現細胞に取り込まれ解糖系代謝物質に異化されるか検討した結果,KB細胞ではDR5Pと乳酸への代謝が確認できたが,HUVECと正常線維芽細胞MRC5では検出できなかった.この結果からdDRがTP非発現腫瘍細胞で炭素源として使用される可能性がある39).
これらのin vitroで確認できた代謝経路が生体内でも機能しているのかどうかを調べるために,TPとともにウリジンホスホリラーゼ(UP)を欠失したTP-UPダブルノックアウト(DKO)マウスを用いてメタボローム解析を行った.マウスのUPはTP活性が高いことが知られているために,我々はUPも欠失させたマウスを過去に作製している40).野生型のB6マウスとTP-UP DKOマウスについてTP活性の比較的高い組織として肝臓を用いて解析した結果,236種類の代謝物質を検出し,そのうちの56の代謝物質に2群間で有意な変化を見いだした.パスウェイエンリッチメント解析の結果から解糖系,PPP,クエン酸回路に違いがみられた.野生型マウスでは特に解糖系のGAPからホスホエノールピルビン酸(PEP)までの量がTP-UP DKOマウスよりも高かった.次に野生型マウスとTP-UP DKOマウスに13C5チミジンを尾静注後3分での代謝物を解析すると,TP-UP DKOマウスの肝臓ではおよそ2倍の13C5チミジンの蓄積が認められた.一方,野生型マウスではTP-UP DKOマウスと比較して13C乳酸が3倍高かった39).
また,Yumoto細胞を免疫不全マウスの背部皮下に異種移植して13C5チミジンを尾静注し,TP発現の高い肝臓とがん組織,発現の低い脾臓での代謝を0分,3分,10分後に臓器を回収して検討した.その結果,13C5チミジンは脾臓では静注から3分をピークとして10分後でも1/2程度の蓄積が認められたが,肝臓とがん細胞では3分後には脾臓の1/4程度の量をピークとして10分後には検出できなくなっており,逆に脾臓に比べて2倍以上の13C乳酸の増加が3分,10分後で示された.これらの結果からマウス生体でチミジンがTP活性に依存して解糖系へ流入していることが明らかとなった(図3)39).
すでに胃がんのメタボローム解析の結果から,がん部では隣接する非がん部に比べてグルコースが減少していることが報告されている41).また,TPが胃がんで高発現しており,その発現が予後不良と相関することも報告されている.これらの結果からヒトの胃がんでTP発現によるチミジンの異化が高まっている可能性が予想された.ヒトの胃がんとその周辺正常組織12例でのメタボローム解析データを用いて,チミジンとDR1PとDR5Pの合計量すなわちリン酸化デオキシリボース(DRP)を比較したところ,胃がん部ではチミジンは減少し,逆にDRPは増加しており有意に逆相関していた39).これらのことはがん部でのTPの活性の上昇に一致する結果であった.
さらに,DRPが高い群と低い群に中央値で分けて,解糖系,PPP,クエン酸回路の中間代謝物質について比較した.その結果DRPが高い,すなわちTP活性が高いと考えられる症例ではATPを含めて多くの代謝物が増加傾向にあり,NADPHは有意に高かった.チミジンの異化の亢進がこれらの代謝を活性化している可能性が示唆された(田畑,未発表).このようにTPの発現は,ある種のがん細胞の低栄養環境での細胞生存に寄与していることが明らかになった.
引用文献References
1) Ishikawa, F., Miyazono, K., Hellman, U., Drexler, H., Wernstedt, C., Hagiwara, K., Usuki, K., Takaku, F., Risau, W., & Heldin, C.H. (1989) Identification of angiogenic activity and the cloning and expression of platelet-derived endothelial cell growth factor. Nature, 338, 557–562.
2) Asai, K., Hirano, T., Kaneko, S., Moriyama, A., Nakanishi, K., Isobe, I., Eksioglu, Y.Z., & Kato, T. (1992) A novel glial growth inhibitory factor, gliostatin, derived from neurofibroma. J. Neurochem., 59, 307–317.
3) Furukawa, T., Yoshimura, A., Sumizawa, T., Haraguchi, M., Akiyama, S., Fukui, K., Ishizawa, M., & Yamada, Y. (1992) Angiogenic factor. Nature, 356, 668.
4) Sumizawa, T., Furukawa, T., Haraguchi, M., Yoshimura, A., Takeyasu, A., Ishizawa, M., Yamada, Y., & Akiyama, S. (1993) Thymidine phosphorylase activity associated with platelet-derived endothelial cell growth factor. J. Biochem., 114, 9–14.
5) Usuki, K., Saras, J., Waltenberger, J., Miyazono, K., Pierce, G., Thomason, A., & Heldin, C.H. (1992) Platelet-derived endothelial cell growth factor has thymidine phosphorylase activity. Biochem. Biophys. Res. Commun., 184, 1311–1316.
6) Moghaddam, A. & Bicknell, R. (1992) Expression of platelet-derived endothelial cell growth factor in Escherichia coli and confirmation of its thymidine phosphorylase activity. Biochemistry, 31, 12141–12146.
7) Nishino, I., Spinazzola, A., & Hirano, M. (1999) Thymidine phosphorylase gene mutations in MNGIE, a human mitochondrial disorder. Science, 283, 689–692.
8) Bronckaers, A., Gago, F., Balzarini, J., & Liekens, S. (2009) The dual role of thymidine phosphorylase in cancer development and chemotherapy. Med. Res. Rev., 29, 903–953.
9) Furukawa, T., Tabata, S., Yamamoto, M., Kawahara, K., Shinsato, Y., Minami, K., Shimokawa, M., & Akiyama, S.I. (2018) Thymidine phosphorylase in cancer aggressiveness and chemoresistance. Pharmacol. Res., 132, 15–20.
10) Haraguchi, M., Miyadera, K., Uemura, K., Sumizawa, T., Furukawa, T., Yamada, K., Akiyama, S., & Yamada, Y. (1994) Angiogenic activity of enzymes. Nature, 368, 198.
11) Miyadera, K., Sumizawa, T., Haraguchi, M., Yoshida, H., Konstanty, W., Yamada, Y., & Akiyama, S. (1995) Role of thymidine phosphorylase activity in the angiogenic effect of platelet derived endothelial cell growth factor/thymidine phosphorylase. Cancer Res., 55, 1687–1690.
12) Matsushita, S., Nitanda, T., Furukawa, T., Sumizawa, T., Tani, A., Nishimoto, K., Akiba, S., Miyadera, K., Fukushima, M., Yamada, Y., et al. (1999) The effect of a thymidine phosphorylase inhibitor on angiogenesis and apoptosis in tumors. Cancer Res., 59, 1911–1916.
13) Uchimiya, H., Furukawa, T., Okamoto, M., Nakajima, Y., Matsushita, S., Ikeda, R., Gotanda, T., Haraguchi, M., Sumizawa, T., Ono, M., et al. (2002) Suppression of thymidine phosphorylase-mediated angiogenesis and tumor growth by 2-deoxy-L-ribose. Cancer Res., 62, 2834–2839.
14) Hotchkiss, K.A., Ashton, A.W., & Schwartz, E.L. (2003) Thymidine phosphorylase and 2-deoxyribose stimulate human endothelial cell migration by specific activation of the integrins alpha 5 beta 1 and alpha V beta 3. J. Biol. Chem., 278, 19272–19279.
15) Fukushima, M., Suzuki, N., Emura, T., Yano, S., Kazuno, H., Tada, Y., Yamada, Y., & Asao, T. (2000) Structure and activity of specific inhibitors of thymidine phosphorylase to potentiate the function of antitumor 2′-deoxyribonucleosides. Biochem. Pharmacol., 59, 1227–1236.
16) Perez-Perez, M.J., Priego, E.M., Hernandez, A.I., Camarasa, M.J., Balzarini, J., & Liekens, S. (2005) Thymidine phosphorylase inhibitors: Recent developments and potential therapeutic applications. Mini Rev. Med. Chem., 5, 1113–1123.
17) Lechertier, T. & Hodivala-Dilke, K. (2012) Focal adhesion kinase and tumour angiogenesis. J. Pathol., 226, 404–412.
18) Waguri, Y., Otsuka, T., Sugimura, I., Matsui, N., Asai, K., Moriyama, A., & Kato, T. (1997) Gliostatin/platelet-derived endothelial cell growth factor as a clinical marker of rheumatoid arthritis and its regulation in fibroblast-like synoviocytes. Br. J. Rheumatol., 36, 315–321.
19) Creamer, D., Allen, M.H., Sousa, A., Poston, R., & Barker, J.N. (1997) Localization of endothelial proliferation and microvascular expansion in active plaque psoriasis. Br. J. Dermatol., 136, 859–865.
20) Goto, H., Kohno, K., Sone, S., Akiyama, S., Kuwano, M., & Ono, M. (2001) Interferon gamma-dependent induction of thymidine phosphorylase/platelet-derived endothelial growth factor through gamma-activated sequence-like element in human macrophages. Cancer Res., 61, 469–473.
21) Zhu, G.H., Lenzi, M., & Schwartz, E.L. (2002) The Sp1 transcription factor contributes to the tumor necrosis factor-induced expression of the angiogenic factor thymidine phosphorylase in human colon carcinoma cells. Oncogene, 21, 8477–8485.
22) Ikuta, K., Waguri-Nagaya, Y., Kikuchi, K., Yamagami, T., Nozaki, M., Aoyama, M., Asai, K., & Otsuka, T. (2012) The Sp1 transcription factor is essential for the expression of gliostatin/thymidine phosphorylase in rheumatoid fibroblast-like synoviocytes. Arthritis Res. Ther., 14, R87.
23) Takebayashi, Y., Yamada, K., Miyadera, K., Sumizawa, T., Furukawa, T., Kinoshita, F., Aoki, D., Okumura, H., Yamada, Y., Akiyama, S., et al. (1996) The activity and expression of thymidine phosphorylase in human solid tumours. Eur. J. Cancer, 32A, 1227–1232.
24) Giatromanolaki, A., Koukourakis, M.I., Theodossiou, D., Barbatis, K., O’Byrne, K., Harris, A.L., & Gatter, K.C. (1997) Comparative evaluation of angiogenesis assessment with anti-factor-VIII and anti-CD31 immunostaining in non-small cell lung cancer. Clin. Cancer Res., 3, 2485–2492.
25) Takebayashi, Y., Natsugoe, S., Baba, M., Akiba, S., Fukumoto, T., Miyadera, K., Yamada, Y., Takao, S., Akiyama, S., & Aikou, T. (1999) Thymidine phosphorylase in human esophageal squamous cell carcinoma. Cancer, 85, 282–289.
26) Takao, S., Akiyama, S.I., Nakajo, A., Yoh, H., Kitazono, M., Natsugoe, S., Miyadera, K., Fukushima, M., Yamada, Y., & Aikou, T. (2000) Suppression of metastasis by thymidine phosphorylase inhibitor. Cancer Res., 60, 5345–5348.
27) Takebayashi, Y., Akiyama, S., Akiba, S., Yamada, K., Miyadera, K., Sumizawa, T., Yamada, Y., Murata, F., & Aikou, T. (1996) Clinicopathologic and prognostic significance of an angiogenic factor, thymidine phosphorylase, in human colorectal carcinoma. J. Natl. Cancer Inst., 88, 1110–1117.
28) Shimaoka, S., Matsushita, S., Nitanda, T., Matsuda, A., Nioh, T., Suenaga, T., Nishimata, Y., Akiba, S., Akiyama, S., & Nishimata, H. (2000) The role of thymidine phosphorylase expression in the invasiveness of gastric carcinoma. Cancer, 88, 2220–2227.
29) Imazano, Y., Takebayashi, Y., Nishiyama, K., Akiba, S., Miyadera, K., Yamada, Y., Akiyama, S., & Ohi, Y. (1997) Correlation between thymidine phosphorylase expression and prognosis in human renal cell carcinoma. J. Clin. Oncol., 15, 2570–2578.
30) van Triest, B., Pinedo, H.M., Blaauwgeers, J.L., van Diest, P.J., Schoenmakers, P.S., Voorn, D.A., Smid, K., Hoekman, K., Hoitsma, H.F., & Peters, G.J. (2000) Prognostic role of thymidylate synthase, thymidine phosphorylase/platelet-derived endothelial cell growth factor, and proliferation markers in colorectal cancer. Clin. Cancer Res., 6, 1063–1072.
31) O’Brien, T.S., Fox, S.B., Dickinson, A.J., Turley, H., Westwood, M., Moghaddam, A., Gatter, K.C., Bicknell, R., & Harris, A.L. (1996) Expression of the angiogenic factor thymidine phosphorylase/platelet-derived endothelial cell growth factor in primary bladder cancers. Cancer Res., 56, 4799–4804.
32) Gotanda, T., Haraguchi, M., Tachiwada, T., Shinkura, R., Koriyama, C., Akiba, S., Kawahara, M., Nishiyama, K., Sumizawa, T., Furukawa, T., et al. (2006) Molecular basis for the involvement of thymidine phosphorylase in cancer invasion. Int. J. Mol. Med., 17, 1085–1091.
33) Nakajima, Y., Haraguchi, M., Furukawa, T., Yamamoto, M., Nakanishi, H., Tatematsu, M., & Akiyama, S. (2006) 2-Deoxy-L-ribose inhibits the invasion of thymidine phosphorylase-overexpressing tumors by suppressing matrix metalloproteinase-9. Int. J. Cancer, 119, 1710–1716.
34) Tabata, S., Ikeda, R., Yamamoto, M., Shimaoka, S., Mukaida, N., Takeda, Y., Yamada, K., Soga, T., Furukawa, T., & Akiyama, S. (2014) Thymidine phosphorylase activates NFkappaB and stimulates the expression of angiogenic and metastatic factors in human cancer cells. Oncotarget, 5, 10473–10485.
35) Tabata, S., Yamamoto, M., Goto, H., Hirayama, A., Ohishi, M., Kuramoto, T., Mitsuhashi, A., Ikeda, R., Haraguchi, M., Kawahara, K., et al. (2018) Thymidine catabolism promotes NADPH oxidase-derived reactive oxygen species (ROS) signalling in KB and yumoto cells. Sci. Rep., 8, 6760.
36) Tabata, S., Ikeda, R., Yamamoto, M., Furukawa, T., Kuramoto, T., Takeda, Y., Yamada, K., Haraguchi, M., Nishioka, Y., Sone, S., et al. (2012) Thymidine phosphorylase enhances reactive oxygen species generation and interleukin-8 expression in human cancer cells. Oncol. Rep., 28, 895–902.
37) Brown, N.S. & Bicknell, R. (1998) Thymidine phosphorylase, 2-deoxy-D-ribose and angiogenesis. Biochem. J., 334, 1–8.
38) Seeliger, H., Guba, M., Koehl, G.E., Doenecke, A., Steinbauer, M., Bruns, C.J., Wagner, C., Frank, E., Jauch, K.W., & Geissler, E.K. (2004) Blockage of 2-deoxy-D-ribose-induced angiogenesis with rapamycin counteracts a thymidine phosphorylase-based escape mechanism available for colon cancer under 5-fluorouracil therapy. Clin. Cancer Res., 10, 1843–1852.
39) Tabata, S., Yamamoto, M., Goto, H., Hirayama, A., Ohishi, M., Kuramoto, T., Mitsuhashi, A., Ikeda, R., Haraguchi, M., Kawahara, K., et al. (2017) Thymidine catabolism as a metabolic strategy for cancer survival. Cell Rep., 19, 1313–1321.
40) Haraguchi, M., Tsujimoto, H., Fukushima, M., Higuchi, I., Kuribayashi, H., Utsumi, H., Nakayama, A., Hashizume, Y., Hirato, J., Yoshida, H., et al. (2002) Targeted deletion of both thymidine phosphorylase and uridine phosphorylase and consequent disorders in mice. Mol. Cell. Biol., 22, 5212–5221.
41) Hirayama, A., Kami, K., Sugimoto, M., Sugawara, M., Toki, N., Onozuka, H., Kinoshita, T., Saito, N., Ochiai, A., Tomita, M., et al. (2009) Quantitative metabolome profiling of colon and stomach cancer microenvironment by capillary electrophoresis time-of-flight mass spectrometry. Cancer Res., 69, 4918–4925.